题目内容
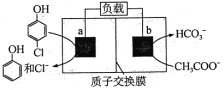
【题目】(1)用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如下:

c电极的反应方程式为:__________________________。
(2)有机物C4H10与氯气发生取代反应,生成的一氯代物有_______种。
(3) 已知反应H2(g)+Br2(l)2HBr(g)在25 ℃、101 kPa下进行,放出热量为72 kJ,蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其他相关数据如下表:
H2(g) | Br2(g) | HBr(g) | |
1 mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | a | 369 |
则表中a为(_____________)
(4) 元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。

一定条件,在水溶液中1 mol Cl-、ClOX-(x=1,2,3,4)的能量(KJ)相对大小如上图所示。
①D是__________(填离子符号)。
②B→A+C反应的离子方程式为__________________;
【答案】CH3OH-6e-+H2O===CO2+6H+ 4 230 ClO4- 3ClO-=ClO3-+2Cl-
【解析】
(1)因c是电子流出的一极,则c为负极,d为正极,CH3OH具有还原性,在负极上发生氧化反应生成CO2,电极反应式为:CH3OH-6e-+H2O=CO2+6H+;
(2)分子式为C4H10的烷烃为丁烷,丁烷存在正丁烷和异丁烷两种同分异构体,正丁烷CH3CH2CH2CH3有2氢原子,所以其一氯代物有2;
异丁烷CH3CH(CH3)CH3有2氢原子,其一氯代物有2种,所以丁烷的一氯代物的同分异构体总共有4种;
(3)在H2(g)+Br2(l)=2HBr(g)△H=-42kJ/mol反应中,1mol Br2(g)液化放出的能量为30kJ,即Br2(g)=Br2(l)△H=-30kJ/mol,则H2(g)+Br2(g)=2HBr(g)△H=-72kJ/mol,反应热等于反应物的总键能减生成物的总键能,则-72=436+a-2×369,a=230;
(4)①根据图象知,D中Cl元素化合价为+7价,所以ClOx-中x为4,则D为ClO4-;
②B→A+C,根据转移电子守恒得该反应的离子方程式为3ClO-=ClO3-+2Cl-。