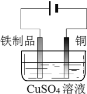题目内容
【题目】研究汽车尾气的产生、转化对环境保护有重要意义。汽车尾气管中的三元催化剂能同时实现CO、CxHy、NOn三种成分的净化。
(1)已知热化学方程式:
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
N2(g)+O2(g)![]() 2NO(g) ΔH=+180 kJ·mol-1
2NO(g) ΔH=+180 kJ·mol-1
则反应CH4(g)+4NO(g)=CO2(g)+2N2(g)+2H2O(l) ΔH=____kJ·mol-1。
(2)研究表明,温度对CO、CxHy、NOn的产生和排放有较大影响。
①汽车发动机内的温度越高,生成的NO越多,原因是____。
②当汽车刚冷启动时,汽车尾气管排放的CO、CxHy、NOn浓度较高,一段时间后浓度逐渐降低。汽车刚冷启动时排放CO、CxHy、NOn浓度较高的原因是____。
(3)催化剂表面CO、CxHy、NOn的转化如图1所示,化合物W可借助图2 (傅里叶红外光谱图)确定。

①在图1所示转化中,W的化学式为____。若转化Ⅱ中消耗CO的物质的量为1mol,生成N2的物质的量为1mol,则被CxHy还原的W的物质的量为____。
②用H2代替CO、CxHy与W反应,该过程相关物质浓度随时间的变化关系如图3所示。该过程分为两步,第一步反应消耗的H2与W的物质的量之比是____。
(4)尾气净化过程中,有时会产生N2O。用同位素示踪法研究发现N2O的产生与NO有关。在有氧条件下15NO与NH3以一定比例反应时,得到的N2O几乎都是15NNO。写出该反应的化学方程式:____。
【答案】-1250.3 N2和O2反应为吸热反应,升高温度有利于平衡正向移动 刚冷启动时,尾气管内催化剂温度低,催化效率低(或刚冷启动时,尾气管处温度低,反应速率慢) Ba(NO3)2 0.8mol 8∶1 415NO+4NH3+3O2 415NNO+6H2O
415NNO+6H2O
【解析】
(1) 根据盖斯定律进行计算;
(2)①N2和O2反应为吸热反应,升高温度有利于平衡正向移动;
②刚冷启动时,尾气管内催化剂温度低,催化效率低(或刚冷启动时,尾气管处温度低,反应速率慢);
(3) ①在图1所示的转化中N、O化合价降低,为氧化剂被还原;
②第一步反应中H2被氧化生成水,化合价由0价升高到+1价,Ba (NO3) 2的N元素化合价由+5价降低到-3价,生成氨气,结合得失电子数目相等计算;
(4)在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO由N元素守恒可知15NO与NH3应为1: 1,结合电子得失相等配平。
(1)已知①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890.3 kJ·mol-1
②N2(g)+O2(g)![]() 2NO(g) ΔH2=+180 kJ·mol-1
2NO(g) ΔH2=+180 kJ·mol-1
根据盖斯定律,由①-②![]() 2得反应CH4(g)+4NO(g)=CO2(g)+2N2(g)+2H2O(l) ΔH=-1250.3kJ·mol-1;
2得反应CH4(g)+4NO(g)=CO2(g)+2N2(g)+2H2O(l) ΔH=-1250.3kJ·mol-1;
(2)①N2和O2反应为吸热反应,升高温度有利于平衡正向移动,故汽车发动机内的温度越高,生成的NO越多;
②当汽车刚冷启动时,汽车尾气管排放的CO、CxHy、NOn浓度较高,一段时间后浓度逐渐降低。刚冷启动时,尾气管内催化剂温度低,催化效率低(或刚冷启动时,尾气管处温度低,反应速率慢),排放CO、CxHy、NOn浓度较高;
(3)①在图1所示的转化中N、O化合价降低为氧化剂被还原;由傅里叶红外光谱图(如图2所示)确定化合物X含硝酸根,再结合图一由钡离子参与,所以X为Ba(NO3)2;
若转化Ⅱ中消耗CO的物质的量为1mol,生成N2的物质的量为1mol,Ba(NO3)2的N元素化合价由+5价降低到0价, 生成氮气,则1molBa(NO3)2生成氮气的过程中得到10mol电子,其中CO转化为CO2的过程中提供2mol电子,即被CO还原的部分是0.2mol,则被CxHy还原的Ba(NO3)2的物质的量为0.8mol;
②第一步反应中H2被氧化生成水,化合价由0价升高到+1价,Ba(NO3)2的N元素化合价由+5价降低到- 3价, 生成氨气,则1molBa(NO3)2,生成氨气转移16mol电子,参加反应的氢气的物质的量为![]() = 8mol,则消耗的H2与Ba(NO3)2的物质的量之比是8:1;
= 8mol,则消耗的H2与Ba(NO3)2的物质的量之比是8:1;
(4)在有氧条件下15NO与NH3以一定比例反应时, 得到的笑气几乎都是15NNO,由N元素守恒可知15N0与NH3应为1 : 1,可知反应的化学方程式为415NO+4NH3+3O2 415NNO+6H2O。
415NNO+6H2O。

【题目】[实验化学]
3,5-二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成。一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5-二甲氧基苯酚的部分物理性质见下表:
物质 | 沸点/℃ | 熔点/℃ | 密度(20℃) / g·cm-3 | 溶解性 |
甲醇 | 64. 7 |
| 0. 7915 | 易溶于水 |
乙醚 | 34. 5 |
| 0. 7138 | 微溶于水 |
3,5-二甲氧基苯酚 |
| 33 ~36 |
| 易溶于甲醇、乙醚,微溶于水 |
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取。①分离出甲醇的操作是的_________。
②萃取用到的分液漏斗使用前需_______并洗净,分液时有机层在分液漏斗的_____填(“上”或“下”)层。
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤。用饱和NaHCO3溶液洗涤的目的是______________;用饱和食盐水洗涤的目的是______________。
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是_____(填字母)。
a.蒸馏除去乙醚 b..重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)固液分离常采用减压过滤。为了防止倒吸,减压过滤完成后应先_______,再______。