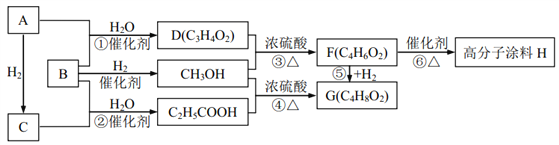
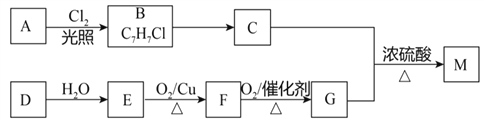
题目内容
【题目】下列说法正确的是( )
A. 常温下,C(s)+H2O(g)![]() CO(g)+H2(g) 不能自发进行,则该反应的ΔH>0
CO(g)+H2(g) 不能自发进行,则该反应的ΔH>0
B. 用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大
C. 粗锌与稀硫酸反应制氢气比纯锌快,是因为粗锌比纯锌还原性强
D. 常温下,在0.1 mol/L氨水中,加入少量NH4Cl晶体,溶液的pH减小
【答案】AD
【解析】试题分析:A.常温下,反应C(s)+H2O(g)![]() CO(g)+H2(g)不能自发进行,△S>0,△H-T△S>0,则该反应的△H>O,故A正确;B.醋酸为弱酸,pH均为2的盐酸和醋酸溶液,两种溶液中H+离子浓度相等,则醋酸浓度大与盐酸,设盐酸的浓度为C1,醋酸的浓度为C2,则C1<C2,分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化钠恰好被完全中和时,消耗的两种酸的物质的量相等,则有:n=C1V1=C2V2,因C1<C2,所以:V1>V2,消耗盐酸的体积更大,故B错误;C.粗锌与稀硫酸反应制氢气比纯锌快,是因为粗锌与稀硫酸反应时存在原电池反应,故C错误;D.常温下,在0.1 mol/L氨水中,加入少量NH4Cl晶体,溶解平衡逆向移动,OH-降低,溶液的pH减小,故D正确,答案为AD。
CO(g)+H2(g)不能自发进行,△S>0,△H-T△S>0,则该反应的△H>O,故A正确;B.醋酸为弱酸,pH均为2的盐酸和醋酸溶液,两种溶液中H+离子浓度相等,则醋酸浓度大与盐酸,设盐酸的浓度为C1,醋酸的浓度为C2,则C1<C2,分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化钠恰好被完全中和时,消耗的两种酸的物质的量相等,则有:n=C1V1=C2V2,因C1<C2,所以:V1>V2,消耗盐酸的体积更大,故B错误;C.粗锌与稀硫酸反应制氢气比纯锌快,是因为粗锌与稀硫酸反应时存在原电池反应,故C错误;D.常温下,在0.1 mol/L氨水中,加入少量NH4Cl晶体,溶解平衡逆向移动,OH-降低,溶液的pH减小,故D正确,答案为AD。

【题目】(1)下图的虚线框中每一列、每一行相当于课本附录的元素周期表的每一族和每一周期,并已标出氢元素的位置,但它的列数和行数都多于元素周期表。请在虚线框中用实线画出周期表第一至第五周期的轮廓,并画出金属与非金属的分界线________。

(2)部分短周期主族元素的原子半径及主要化合价
元素 | 甲 | 乙 | 丙 | 丁 | 戊 | 己 | 庚 | 辛 |
原子半径(nm) | 0.077 | 0.143 | 0.111 | 0.104 | 0.066 | 0.186 | 0.037 | 0.099 |
主要化合价 | +4,-4 | +3 | +2 | +6,-2 | -2 | +1 | +1 | +7,-1 |
①乙元素的原子结构示意图____________,丙在元素周期表中的位置___________,戊、庚、辛以原子个数比1∶1∶1形成的化合物的结构式______________。
②甲的单质与丁的最高价氧化物的水化物反应的化学方程式是___________,辛的单质与己的最高价氧化物的水化物反应的离子方程式是______________________________。
【题目】下表是几种弱电解质的电离平衡常数 (25℃)。
电解质 | 电离方程式 | 平衡常数K |
CH3COOH | CH3COOH | 1.76 × 10 -5 |
H2CO3 | H2CO3 HCO3— | K1=4.31 × 10 -7 K2=5.61 × 10 -11 |
C6H5OH | C6H5OH | 1.1 × 10 -10 |
H3PO4 | H3PO4 H2PO4— HPO42— | K1=7.52 × 10 -3 K2=6.23× 10 -8 K3=2.20× 10 -13 |
NH3·H2O | NH3·H2O | 1.76× 10 -5 |
回答下列问题(C6H5OH为苯酚):
(1)由上表分析,若 ① CH3COOH ② HCO3— ③ C6H5OH ④ H2PO4— 均可看作酸,则它们酸性由强到弱的顺序为___________(填编号);
(2)写出C6H5OH与Na3PO4反应的离子方程式:__________________________;
(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO—)______c(NH4+);(填“>”、“=”或“<”)
(4)25℃时,向10 mL 0.01 mol/L苯酚溶液中滴加V mL 0.01 mol/L氨水,混合溶液中粒子浓度关系正确的是______;
A.若混合液pH>7,则V≥ 10
B.若混合液pH<7,则c((NH4+) >c (C6H5O—) >c (H+)>c (OH—)
C.V=10时,混合液中水的电离程度小于10 mL 0.01mol/L苯酚溶液中水的电离程度
D.V=5时,2c(NH3·H2O)+ 2 c (NH4+)= c (C6H5O—)+ c (C6H5OH)
(5)水解反应是典型的可逆反应.水解反应的化学平衡常数称为水解常数(用Kh表示),类比化学平衡常数的定义,请写出Na2CO3第一步水解反应的水解常数的表达式_______________。