题目内容
【题目】(1)下图的虚线框中每一列、每一行相当于课本附录的元素周期表的每一族和每一周期,并已标出氢元素的位置,但它的列数和行数都多于元素周期表。请在虚线框中用实线画出周期表第一至第五周期的轮廓,并画出金属与非金属的分界线________。

(2)部分短周期主族元素的原子半径及主要化合价
元素 | 甲 | 乙 | 丙 | 丁 | 戊 | 己 | 庚 | 辛 |
原子半径(nm) | 0.077 | 0.143 | 0.111 | 0.104 | 0.066 | 0.186 | 0.037 | 0.099 |
主要化合价 | +4,-4 | +3 | +2 | +6,-2 | -2 | +1 | +1 | +7,-1 |
①乙元素的原子结构示意图____________,丙在元素周期表中的位置___________,戊、庚、辛以原子个数比1∶1∶1形成的化合物的结构式______________。
②甲的单质与丁的最高价氧化物的水化物反应的化学方程式是___________,辛的单质与己的最高价氧化物的水化物反应的离子方程式是______________________________。
【答案】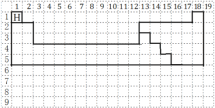
![]() 第2周期第IIA族H-O-ClC+2H2SO4(浓)
第2周期第IIA族H-O-ClC+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2OCl2+2OH-=Cl-+ClO-+H2O
CO2↑+2SO2↑+2H2OCl2+2OH-=Cl-+ClO-+H2O
【解析】
(1)周期表中第一周期2种元素,第二周期含8种元素,第三周期开始出现过渡元素,从第二周期开始,出现金属与非金属交界,用实线画出周期表第一至第五周期的轮廓,并画出金属与非金属的分界线如图为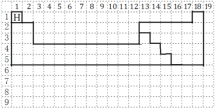 ;
;
(2)主族元素的最高化合价与其族序数相等,故己、庚为第ⅠA族,丁、戊为第ⅥA族,丁是S,戊是O,所以己是Na,庚是H;辛的最高价是+7价,最低价是-1价,则辛是Cl;甲有-4价和+4价,原子半径大于戊小于丁,则甲是C;根据乙、丙的最高价和原子半径可知乙是Al,丙是Be。则
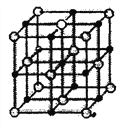
①乙元素是Al,原子结构示意图为![]() ,丙是Be,在元素周期表中的位置为第2周期第IIA族,戊、庚、辛以原子个数比1∶1∶1形成的化合物是次氯酸,结构式为H-O-Cl。
,丙是Be,在元素周期表中的位置为第2周期第IIA族,戊、庚、辛以原子个数比1∶1∶1形成的化合物是次氯酸,结构式为H-O-Cl。
②甲的单质碳与丁的最高价氧化物的水化物浓硫酸反应的化学方程式为C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O,辛的单质氯气与己的最高价氧化物的水化物氢氧化钠反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O。
CO2↑+2SO2↑+2H2O,辛的单质氯气与己的最高价氧化物的水化物氢氧化钠反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O。

 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案【题目】下列实验方案中,能达到相应实验目的的是
实验方案 |
|
|
|
|
目的 | A.比较乙醇分子中羟基氢原子和水分子中氢原子的活泼性 | B.除去乙烯中的二氧化硫 | C.制银氨溶液 | D.证明碳酸酸性强于苯酚 |
A. A B. B C. C D. D