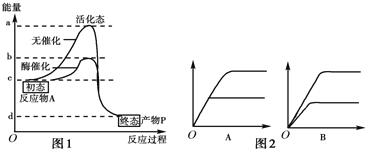
题目内容
【题目】如图所示装置中,金属镁、铝和电流表通过导线相连: 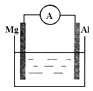
(1)若烧杯中溶液为稀硫酸,两极的电极反应式为: 负极;
正极 .
(2)若烧杯中溶液为氢氧化钠溶液,两极的电极反应式为: 负极;
正极 .
【答案】
(1)Mg﹣2e﹣=Mg2+;2H++2e﹣=H2↑
(2)Al+4OH﹣﹣3e﹣=AlO2﹣+2H2O;2H2O+2e﹣=H2↑+2OH﹣
【解析】解:(1)镁、铝和稀硫酸构成了原电池,金属镁做负极,电极反应:Mg﹣2e﹣=Mg2+ , 金属铝为正极,溶液中的2H+得到电子发生还原反应,电极反应为:2H++2e﹣=H2↑; 所以答案是:Mg﹣2e﹣=Mg2+;2H++2e﹣=H2↑.(2)镁、铝和NaOH溶液构成了原电池,铝易失电子作负极,电极反应式为Al+4OH﹣﹣3e﹣=AlO2﹣+2H2O,正极上水得电子发生还原反应,电极反应式为2H2O+2e﹣=H2↑+2OH﹣ ,
所以答案是:Al+4OH﹣﹣3e﹣=AlO2﹣+2H2O;2H2O+2e﹣=H2↑+2OH﹣ .

练习册系列答案
相关题目
【题目】除去下列物质中所含少量杂质(括号内为杂质),所选用的试剂和分离方法能达到实验目的是( )
混合物 | 试剂 | 分离方法 | |
A | 苯(苯酚) | 溴水 | 过滤 |
B | 乙烷(乙烯) | 氢气 | 加热 |
C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
D | 淀粉(氯化钠) | 蒸馏水 | 渗析 |
A.A
B.B
C.C
D.D