题目内容
某校化学研究性学习小组的同学在学习了氨的性质时讨论:既然氨气具有还原性,能否像H2那样还原CuO呢?他们设计实验制取氨气并探究上述问题.请你参与该小组的活动并完成下列研究:
(1)制取氨气
①写出实验室用固体氯化铵和熟石灰粉末混合加热制取氨气的化学方程式
②在实验室中,还可以用浓氨水与
③有同学模仿排饱和食盐水收集氯气的方法,想用排饱和氯化铵溶液的方法收集氨气.你认为他能否达到目的?
(2)该小组中某同学设计了如图所示的实验装置(夹持及尾气处理装置未画出),探究氨气的还原性:
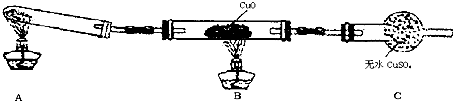
①该装置在设计上有一定缺陷,为保证实验结果的准确性,对该装置的改进措施是
②利用改进后的装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体.写出氨气与CuO反应的化学方程式
(3)问题讨论
有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O.已知:Cu2O是一种碱性氧化物;在酸性溶液中,Cu+的稳定性比Cu2+差(2Cu+→Cu+Cu2+).请你设计一个简单的实验检验该红色物质中是否含有Cu2O
(1)制取氨气
①写出实验室用固体氯化铵和熟石灰粉末混合加热制取氨气的化学方程式
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
| ||
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
;
| ||
②在实验室中,还可以用浓氨水与
NaOH固体或生石灰或碱石灰等
NaOH固体或生石灰或碱石灰等
填写一种试剂名称)快速制取少量氨气;③有同学模仿排饱和食盐水收集氯气的方法,想用排饱和氯化铵溶液的方法收集氨气.你认为他能否达到目的?
否
否
(填“能”或“否”),理由是氨气极易溶于水、氯化铵对氨气在水中的溶解影响不大
氨气极易溶于水、氯化铵对氨气在水中的溶解影响不大
.(2)该小组中某同学设计了如图所示的实验装置(夹持及尾气处理装置未画出),探究氨气的还原性:

①该装置在设计上有一定缺陷,为保证实验结果的准确性,对该装置的改进措施是
在装置A与B之间增加装有碱石灰的干燥管
在装置A与B之间增加装有碱石灰的干燥管
;②利用改进后的装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体.写出氨气与CuO反应的化学方程式
3CuO+2NH3
3Cu+N2+3H2O
| ||
3CuO+2NH3
3Cu+N2+3H2O
.
| ||
(3)问题讨论
有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O.已知:Cu2O是一种碱性氧化物;在酸性溶液中,Cu+的稳定性比Cu2+差(2Cu+→Cu+Cu2+).请你设计一个简单的实验检验该红色物质中是否含有Cu2O
取少许样品,加入稀H2SO4(或稀盐酸),若溶液出现蓝色,说明红色物质中含有Cu2O,反之则没有
取少许样品,加入稀H2SO4(或稀盐酸),若溶液出现蓝色,说明红色物质中含有Cu2O,反之则没有
.分析:(1)①实验室用固体氯化铵和熟石灰粉末混合加热制取氨气的化学方程式为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;
②用浓氨水与NaOH固体或生石灰或碱石灰等混合可以迅速制备少量氨气;
③氨气极易溶于水,氯化铵对氨气的溶解性影响不大;
(2)①氯化铵和消石灰反应生成氨气和水,氨气和CuO反应前应先干燥;
②由题意可知生成物为铜、氮气和水,以此书写化学方程式;
(3)根据Cu2O在酸性条件下不稳定的性质分析.
| ||
②用浓氨水与NaOH固体或生石灰或碱石灰等混合可以迅速制备少量氨气;
③氨气极易溶于水,氯化铵对氨气的溶解性影响不大;
(2)①氯化铵和消石灰反应生成氨气和水,氨气和CuO反应前应先干燥;
②由题意可知生成物为铜、氮气和水,以此书写化学方程式;
(3)根据Cu2O在酸性条件下不稳定的性质分析.
解答:解:(1)①实验室用氯化铵和消石灰反应制备氨气,反应的化学方程式为2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;
②用浓氨水与NaOH固体或生石灰或碱石灰等混合可以迅速制备少量氨气,故答案为:NaOH固体或生石灰或碱石灰等;
③氨气极易溶于水、氯化铵对氨气在水中的溶解影响不大,所以不能用用排饱和氯化铵溶液的方法收集氨气,
故答案为:否;氨气极易溶于水、氯化铵对氨气在水中的溶解影响不大;
(2)①氯化铵和消石灰反应生成氨气和水,氨气和CuO反应前应先干燥,氨气污染空气,C装置后需要连接尾气吸收装置,
故答案为:在装置A与B之间增加装有碱石灰的干燥管;C装置之后增加尾气吸收装置;
②CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体,说明生成铜、氮气和水,反应的化学方程式为3CuO+2NH3
3Cu+N2+3H2O,
故答案为:3CuO+2NH3
3Cu+N2+3H2O;
(3)由题中信息可知,Cu2O是一种碱性氧化物,在酸性溶液中,Cu+的稳定性比Cu2+差(2Cu+=Cu+Cu2+),则将Cu2O加入硫酸中发生:Cu2O+H2SO4=CuSO4+Cu+H2O,可观察到溶液出现蓝色,说明红色物质中含有Cu2O,反之则没有,
故答案为:取少许样品,加入稀硫酸,若溶液出现蓝色,说明红色物质中含有Cu2O,反之则没有.
| ||
故答案为:2NH4Cl+Ca(OH)2
| ||
②用浓氨水与NaOH固体或生石灰或碱石灰等混合可以迅速制备少量氨气,故答案为:NaOH固体或生石灰或碱石灰等;
③氨气极易溶于水、氯化铵对氨气在水中的溶解影响不大,所以不能用用排饱和氯化铵溶液的方法收集氨气,
故答案为:否;氨气极易溶于水、氯化铵对氨气在水中的溶解影响不大;
(2)①氯化铵和消石灰反应生成氨气和水,氨气和CuO反应前应先干燥,氨气污染空气,C装置后需要连接尾气吸收装置,
故答案为:在装置A与B之间增加装有碱石灰的干燥管;C装置之后增加尾气吸收装置;
②CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体,说明生成铜、氮气和水,反应的化学方程式为3CuO+2NH3
| ||
故答案为:3CuO+2NH3
| ||
(3)由题中信息可知,Cu2O是一种碱性氧化物,在酸性溶液中,Cu+的稳定性比Cu2+差(2Cu+=Cu+Cu2+),则将Cu2O加入硫酸中发生:Cu2O+H2SO4=CuSO4+Cu+H2O,可观察到溶液出现蓝色,说明红色物质中含有Cu2O,反之则没有,
故答案为:取少许样品,加入稀硫酸,若溶液出现蓝色,说明红色物质中含有Cu2O,反之则没有.
点评:本题考查铜的化合物的性质探究,题目难度中等,掌握物质性质和实验基本操作是解题关键.

练习册系列答案
相关题目

 某校化学研究性学习小组设计如下实验方案,测定放置己久的小苏打样品中纯碱的质量分数.
某校化学研究性学习小组设计如下实验方案,测定放置己久的小苏打样品中纯碱的质量分数.