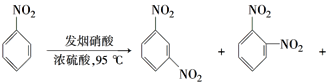
��Ŀ����
����Ŀ��ijС��������ͼװ�ã��ñ�������FeBr3���������Ʊ��屽��

�� | �� | �屽 | |
�ܶ�/g��cm-3 | 0.88 | 3.10 | 1.50 |
�е�/��C | 80 | 59 | 156 |
ˮ���ܽ��� | �� | �� | �� |
ʵ����̣���a�м���15mL��ˮ����������м����b��С�ļ���4.0mLҺ̬�塣��a�е��뼸���塣��Ӧ���ҽ��С���Ӧֹͣ���������̷����ᴿ��Ʒ��
 ��
��
��1����ƿ���д�������ɫ�������Թ�d�е������ǣ���______________���� ����ˮ��ɻ�ɫ��c��������___________________________________��
��2�������ᴿʱ��������Ϊ______________��������Ϊ_________________��
��3����ˮϴ����Ҫ�õ��IJ���������_________���ձ�����ˮϴ��������ˮ���еμ�KSCN��Һ����Һ���ɫ���Ʋ�ˮϴ����ҪĿ���dz�ȥ__________________��
��4����NaOH��Һϴ��ʱ��Ӧ�Ļ�ѧ����ʽ��________________________��
��5����֪�����巢������ȡ����Ӧ���ƲⷴӦ���Թ�d��Һ�庬�е����ִ���������H+��Br�������ʵ�鷽����֤�Ʋ⡣����ѡ�Լ���Mg��CCl4��AgNO3aq��H2O��
ʵ�鲽�� | Ԥ������ | ���� |
����1�����Թ�d��Һ��ת���Һ©���� __________________________________������ȡ��Һ�ȷֳ����ݣ�����A��B���Թ��У����в���2��3�� | ||
����2�� �� | ֤���� ���� | |
����3�� �� | ֤���� ���� |
���𰸡� ���ܿ��а������� �������� ���� ���� ��Һ©�� FeBr3 2NaOH+Br2 = NaBr+NaBrO+H2O
ʵ�鲽�� | Ԥ������ | ���� |
��������CCl4�������÷�Һ��ȡ�ϲ���Һ���Թ��� | ||
��A�м�������Mg | ������ɫ���� | H+ |
��B�м�������AgNO3��Һ | ����dz��ɫ���� | Br |
����������1����м��Һ�巴Ӧ�����廯��������Һ�����廯���������������¾��ҷ�Ӧ�������屽���廯�⡣�廯��е�ͣ����������ܽ�����ƿ�����ܿ���ˮ�Ӵ������γ���������ƿ�г�������ɫ����ƿ������ˮ��ɻ�ɫ������Ϊ��Ӧ���ȣ�����лӷ��ԣ�����Һ��������������в���Br2(g)������ƿ�С�
�ʴ�Ϊ�����ܿ��а���������
��2����Ӧֹͣ��Ӧ������к����屽�������塢FeBr3�Լ�Fe�������̿�֪������I��õ��������������IӦΪ���ˣ����������ΪFe��������Һ��ˮϴ��Һ��ֲ㣬FeBr3������ˮ����ˮ�㣬���������л���ͱ����屽һ������л��㡣��Һ���з��룬�ټ�NaOH��Һ��ȥ�嵥�ʣ��ٴη�Һ��ˮ������Ҫ����NaBr��NaBrO�ȣ��л����к��б����屽�����ڱ����屽�ķе㲻ͬ���ɽ���������II�����롣
�ʴ�Ϊ�����ˣ�����
��3����������������ˮϴ����õ�ˮ����л��࣬Ϊ��Һ����������Ҫ�ձ��⣬����Ҫ��Һ©��������ˮϴ��������ˮ���еμ�KSCN��Һ����Һ���ɫ��˵��ˮ���д��������ӣ���FeBr3����ˮ������ˮ�ࡣ��ˮϴ��Ŀ��Ϊ��ȥFeBr3��
�ʴ�Ϊ����Һ©����FeBr3��
��4��NaOH��Һϴ��Ŀ��Ϊ��ȥBr2����Ӧ����ʽΪ��2NaOH+Br2 = NaBr+NaBrO+H2O��
��5�������巢��ȡ����Ӧ����Ӧ����HBr������ƿ�У���Һ�к��д�����Br����H+������Br2�ӷ�����ƿ�л��ܽ�������Br2�������Ȼ�̼��ȡ���롣�ֱ�ȡ�����ϲ���ɫ��Һ���Թ�A��B�У��Թ�A�е���������ˮ���û����嵥�ʣ���Һ����ɫ���ɫ��֤������Br�������Թ�B�м�þ�����д������ݲ�����֤������H+���ʴ�Ϊ��
ʵ�鲽�� | Ԥ������ | ���� |
��������CCl4�������÷�Һ��ȡ�ϲ���Һ���Թ��� | ||
��A�м�������Mg | ������ɫ���� | H+ |
��B�м�������AgNO3��Һ | ����dz��ɫ���� | Br |

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�