题目内容
某溶液中加入盐酸酸化的氯化钡溶液,无沉淀生成,当再加入硝酸钠时,有沉淀生成,则原溶液中可能含有的离子是
A.SO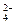 | B.S2- |
C.CO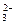 | D.SO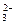 |
BD
先加盐酸后又加入NaNO3,相当于分步加了HNO3,它可将SO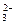 氧化为SO
氧化为SO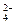 ,与Ba2+形成沉淀,HNO3也可将S2-氧化为S沉淀。
,与Ba2+形成沉淀,HNO3也可将S2-氧化为S沉淀。
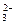 氧化为SO
氧化为SO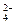 ,与Ba2+形成沉淀,HNO3也可将S2-氧化为S沉淀。
,与Ba2+形成沉淀,HNO3也可将S2-氧化为S沉淀。
练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
题目内容
A.SO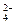 | B.S2- |
C.CO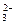 | D.SO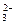 |
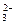 氧化为SO
氧化为SO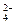 ,与Ba2+形成沉淀,HNO3也可将S2-氧化为S沉淀。
,与Ba2+形成沉淀,HNO3也可将S2-氧化为S沉淀。
 名校课堂系列答案
名校课堂系列答案