题目内容
【题目】室温下向10mL0.1mol/L NaOH溶液中加入0.1mol/L的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( ) 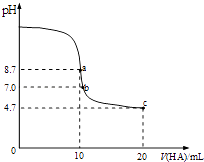
A.a点溶液中:c(Na+)>c(A﹣)>c(H+)>c(HA)
B.a、c两点溶液中水的电离程度相同
C.b点溶液中:c(Na+)=c(A﹣)+c(HA)
D.c点溶液中:c(A﹣)>c(HA)
【答案】D
【解析】解:室温下向10mL0.1mol/L NaOH溶液中加入0.1mol/L的一元酸HA,a点酸碱的物质的量相等,二者恰好反应生成NaA,但溶液呈碱性,说明生成的盐是强碱弱酸盐,则HA是弱酸;要使混合溶液呈中性,则HA应该稍微过量,所以b点HA体积大于10mL,c点溶液中溶质为等物质的量浓度的NaA、HA,溶液呈酸性,说明HA电离程度大于A﹣水解程度;
A.a点时酸碱恰好中和,溶液pH=8.7,说明HA为弱酸,NaA溶液水解呈碱性,应为c(HA)>c(H+),故A错误;
B.a点A﹣水解,促进水的电离,c点时HA过量,溶液呈酸性,HA电离出H+ , 抑制水的电离,故B错误;
C.pH=7时,c(H+)=c(OH﹣),由电荷守恒可知c(Na+)+c(H+)=c(A﹣)+c(OH﹣),则c(Na+)=c(A﹣),故C错误;
D.c点HA过量一倍,溶液存在NaA和HA,溶液呈酸性,说明HA电离程度大于A﹣水解程度,则存在c(A﹣)>c(HA),故D正确;
故选D.

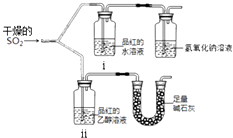
【题目】利用图所示装置进行下列实验,能得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓硫酸 | Cu | KMnO4溶液褪色 | SO2有漂白性 | |
B | 浓盐酸 | MnO2 | FeBr2溶液变为黄色 | 氧化性:Cl2>Br2 | |
C | 稀硫酸 | 碳酸钠 | CaCl2溶液无明显变化 | CO2不与CaCl2溶液反应 | |
D | 浓硫酸 | 蔗糖 | 溴水褪色 | 浓硫酸具有脱水性、吸水性 |
A.A
B.B
C.C
D.D
【题目】下表是周期表中的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ||||||||
2 | B | C | D | E | ||||
3 | A | F | J | G | I |
(1)表中元素,化学性质最不活泼的是_______,最高价氧化物的水化物酸性最强的是__________
(2)B、C、D、E、G形成的气态氢化物中,最稳定的是________________
(3)A元素的最高价氧化物的水化物中所含化学键类型_________________,D元素的简单气态氢化物的电子式为_________,J的某原子中含有15个中子,试用恰当符号表示出该原子________
(4)E、F、G形成的简单离子半径由大到小的顺序________________