题目内容
将51.2g铜恰好完全溶于一定量的硝酸溶液中,得到硝酸铜溶液,收集到氮的氧化物(含NO、NO2、N2O4)的混合物共17.92L(标准状况),在这些气体中通入V L(标准状况)的氧气后用一定量的氢氧化钠溶液吸收,结果剩余2.24L(标准状况)气体.则通入氧气的体积V为( )
| A、7.28L |
| B、8.96L |
| C、11.20L |
| D、16.8L |
考点:化学方程式的有关计算
专题:计算题
分析:Cu与硝酸反应生成硝酸铜与氮的氧化物(含NO、NO2、N2O4),氮的氧化物(含NO、NO2、N2O4)与氧气反应后,后用一定量的氢氧化钠溶液吸收,反应得到NaNO3,
若剩余气体为氧气,根据得失电子守恒,铜失去电子总数等于参加反应的氧气得到电子总数,据此计算参加反应氧气的物质的量,进而计算通入氧气的体积;
若剩余气体为NO,根据得失电子守恒,铜失去电子总数=参加反应的氧气得到电子总数+剩余NO反应生成硝酸获得电子数,据此计算氧气体积.
若剩余气体为氧气,根据得失电子守恒,铜失去电子总数等于参加反应的氧气得到电子总数,据此计算参加反应氧气的物质的量,进而计算通入氧气的体积;
若剩余气体为NO,根据得失电子守恒,铜失去电子总数=参加反应的氧气得到电子总数+剩余NO反应生成硝酸获得电子数,据此计算氧气体积.
解答:
解:Cu与硝酸反应生成硝酸铜与氮的氧化物(含NO、NO2、N2O4),氮的氧化物(含NO、NO2、N2O4)与氧气反应后,后用一定量的氢氧化钠溶液吸收,反应得到NaNO3,
51.2g铜的物质的量=
=0.8mol,
若剩余气体为氧气,根据得失电子守恒,铜失去电子总数等于参加反应的氧气得到电子总数,令参加反应的氧气为xmol,则4x=0.8×2,解得x=0.4,故通入氧气总体积=0.4mol×22.4L/mol+2.24L=11.2L;
若剩余气体为NO,其物质的量=
=0.1mol,根据得失电子守恒,铜失去电子总数=参加反应的氧气得到电子总数+剩余NO反应生成硝酸获得电子数,令参加反应的氧气为ymol,则4y+0.1×(5-2)=0.8×2,解得y=0.325,故通入氧气总体积=0.325mol×22.4L/mol=7.28L,
故选AC.
51.2g铜的物质的量=
| 51.2g |
| 64g/mol |
若剩余气体为氧气,根据得失电子守恒,铜失去电子总数等于参加反应的氧气得到电子总数,令参加反应的氧气为xmol,则4x=0.8×2,解得x=0.4,故通入氧气总体积=0.4mol×22.4L/mol+2.24L=11.2L;
若剩余气体为NO,其物质的量=
| 2.24L |
| 22.4L/mol |
故选AC.
点评:本题考查氧化还原反应计算,明确过程中发生的反应,关键是电子转移守恒关系的确定,题目难度中等.

练习册系列答案
相关题目
不用其他试剂无法鉴别的一组溶液是( )
| A、氯化铁溶液和氯化铜溶液 |
| B、盐酸和碳酸氢钠溶液 |
| C、氯化铝溶液和氢氧化钠溶液 |
| D、硫酸溶液和碳酸钠溶液 |
常温下,四种溶液的pH如下:
下列说法正确的是( )
| 编号 | ① | ② | ③ | ④ |
| 溶液 | 氨水 | 氢氧化钠 | 醋酸 | 硫酸 |
| pH | 11 | 11 | 3 | 3 |
| A、在①、②中分别加入适量的(NH4)2SO4晶体后,①的pH减小,②的pH不变 |
| B、将V1 mL④溶液与 V2 mL②溶液混合后,测得混合溶液pH=4,则V1:V2=9:11 |
| C、分别加水稀释10倍,四种溶液的pH大小顺序为:①>②>③>④ |
| D、将①、④两种溶液等体积混合,所得溶液中:c(NH4+)>c(SO42-)>c(OH-)>c(H+) |
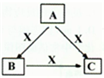 A、B、C、X均为中学化学常见物质,一定条件下它们有如图所示转化关系(其它产物已略去),下列说法错误的是( )
A、B、C、X均为中学化学常见物质,一定条件下它们有如图所示转化关系(其它产物已略去),下列说法错误的是( )| A、若X为O2,则A可为硫化氢 |
| B、若X为KOH溶液,则A可能为AlCl3 |
| C、若X为Fe,则C可能为Fe(NO3)2 |
| D、若A、B、C均为焰色反应呈黄色的化合物,则X可能为Na |
下列叙述正确的是( )
| A、48g O3和O2的混合气体中含有6.02×1023个分子 |
| B、常温常压下,4.6g NO2气体含有1.806×1023个原子 |
| C、0.5mol?L-1 1L CuCl2溶液中含有3.01×1023个Cu2+ |
| D、标准状况下,3.36L H2O含有9.03×1023个分子H2O |
下列说法正确的是( )
| A、Na2SO3与BaCl2溶液作用,有白色沉淀,加稀硝酸后沉淀消失 |
| B、将SO2气体通入Ba(OH)2溶液中没有白色沉淀生成 |
| C、将SO2气体通过BaCl2溶液中有白色沉淀生成 |
| D、将SO2气体通入用硝酸酸化的BaCl2溶液中有白色沉淀生成 |
科学家在《Science》上发表论文,宣布发现了铝的超原子结构Al13和Al14,当这类超原子具有40个价电子(对于主族元素的原子,外围电子又称为价电子)时最稳定,在质谱仪上可检测到稳定到Al13-和Al142+.下列说法错误的是( )
| A、Al13和Al14互为同位素 |
| B、Al13超原子中Al原子间是通过共价键结合的 |
| C、Al13和Al的化学性质相似,都具有较强的还原性 |
| D、Al14和稀盐酸反应的化学方程式可表示为Al14+2HCl→Al14Cl2+H2↑ |