题目内容
【题目】饮用水中的NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO3-还原为N2,其化学方程式为:10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O。请回答下列问题:
(1)上述反应中,__元素的化合价升高,则该元素的原子__(填“得到”或“失去”)电子;而__元素的化合价降低,则该元素的原子被__(填“氧化”或“还原”)。
(2)上述反应中,若有10个铝原子参与反应,则转移的电子总数为__,用“双线桥法”表示反应中电子转移的方向和数目:___
10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O
【答案】Al 失去 N 还原 30 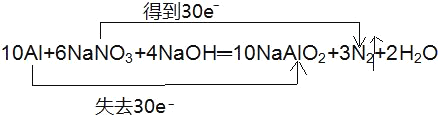
【解析】
10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O中,Al元素化合价升高3价,被氧化,N元素化合价降低5价,被还原,结合化合价的变化判断电子的得失以及电子转移的方向和数目。
(1)Al元素的化合价升高,失去电子,Al被氧化作还原剂,发生氧化反应,N元素化合价降低5价,被还原;
故答案为:Al;失去;N;被还原;
(2)反应中Al元素化合价由0价升高到+3价,则若有10个铝原子参与反应,则转移的电子总数为30;根据方程式知,该反应中转移电子数是30,用双线桥表示电子转移方向和数目为 ,
,
故答案为:30; 。
。

练习册系列答案
相关题目