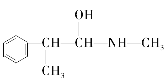题目内容
【题目】1799年由英国化学家汉弗莱·戴维发现一氧化二氮(N2O)气体具有轻微的麻醉作用,而且对心脏、肺等器官无伤害,后被广泛应用于医学手术中。
(1)一氧化二氮早期被用于牙科手术的麻醉,它可由硝酸铵在催化剂下分解制得,该反应的化学方程式为___。
(2)已知反应2N2O(g)=2N2(g)+O2(g) ΔH=-163kJ·mol-1,1molN2(g)、1molO2(g)分子中化学键断裂时分别需要吸收945kJ、498kJ的能量,则1molN2O(g)分子中化学键断裂时需要吸收的能量为___kJ。
(3)一定温度下的恒容容器中,反应2N2O(g)=2N2(g)+O2(g)的部分实验数据如下:
反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
c(N2O)/mol·L-1 | 0.10 | 0.09 | 0.08 | 0.07 | 0.06 | 0.05 | 0.04 | 0.03 | 0.02 | 0.01 | 0.00 |
①在0~20min时段,反应速率v(N2O)为___mol·(L·min)-1。
②若N2O起始浓度c0为0.150mol·L-1,则反应至30min时N2O的转化率α=___。
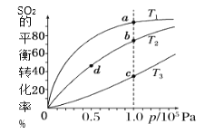
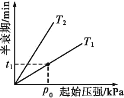
③不同温度(T)下,N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1___(填“>”“=”或“<”)T2。当温度为T1、起始压强为p0时,反应至t1min时,体系压强p=___(用p0表示)。
(4)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步 I2(g)=2I(g)(快反应)
第二步 I(g)+N2O(g)![]() N2(g)+IO(g)(慢反应)
N2(g)+IO(g)(慢反应)
第三步 IO(g)+N2O(g)![]() N2(g)+O2(g)+I(g)(快反应)
N2(g)+O2(g)+I(g)(快反应)
实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。下列表述正确的是___(填标号)。
A.温度升高,k值增大
B.第一步对总反应速率起决定作用
C.第二步活化能比第三步大
D.I2的浓度与N2O分解速率无关
【答案】NH4NO3![]() N2O↑+2H2O 1112.5 1.0×10-3 20.0% > 1.25p0 AC
N2O↑+2H2O 1112.5 1.0×10-3 20.0% > 1.25p0 AC
【解析】
(1)硝酸铵在催化剂下分解生成一氧化二氮和水;
(2)根据反应热=反应物的总键能-生成物的总键能进行计算;
(3)①根据v=![]() 计算速率;
计算速率;
②根据转化率=![]() ×100%进行计算;
×100%进行计算;
③其他条件相同时,温度升高化学反应速率加快,N2O分解半衰期减小;
(4)A.温度升高,化学反应速率增大;
B. 化学反应速率由反应最慢的反应决定,则第二步对总反应速率起决定作用;
C. 反应越慢活化能越大;
D. 根据含碘时NO分解速率方程v=k·c(N2O)·[c(I2)]0.5进行分析。
(1)硝酸铵在催化剂存在时分解生成一氧化二氮和水,反应的化学方程式为NH4NO3![]() N2O↑+2H2O;
N2O↑+2H2O;
(2)对反应2N2O(g)=2N2(g)+O2(g) ΔH=-163kJ·mol-1,设1molN2O(g)分子中化学键断裂时需要吸收的能量为x,根据反应热=反应物的键能总和-生成物的键能总和可得2x-2×945kJ-498 kJ=-163kJ,解得x=1112.5kJ;
(3)①根据表格数据,在0~20min时段,反应速率v(N2O)=1.0×10-3mol·(L·min)-1;
②由表可知,每隔10min,c(N2O)的变化量相等,单位时间内c(N2O)的变化与N2O的起始浓度无关,每10min均减小0.01mol·L-1,若N2O起始浓度c0为0.150mol·L-1,则反应至30min时转化的N2O的浓度为0.01mol·L-1×3=0.03mol·L-1,则N2O的转化率α=![]() ×100%=20.0%;
×100%=20.0%;
③其他条件相同时,温度升高化学反应速率加快,N2O分解半衰期减小,由图可知,压强相同时,对应半衰期T2>T1,则温度T1>T2;当温度为T1、起始压强为p0时,设起始时的物质的量为1 mol,则:
2N2O(g)=2N2(g)+O2(g)
起始量/mol 1 0 0
t1 min时/mol 0.5 0.5 0.25
t1 min时总物质的量为(0.5+0.5+0.25)mol=1.25mol,根据等温等容条件下,压强之比等于物质的量之比,体系压强p=p0=1.25p0;
(4)A.温度升高,化学反应速率增大,因v=k·c(N2O)·[c(I2)]0.5,则温度升高,k值增大,故A项正确;
B.化学反应速率由反应最慢的反应决定,则第二步对总反应速率起决定作用, B项错误;
C.第二步反应为慢反应,第三步反应为快反应,所以第二步活化能比第三步大, C项正确;
D.含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5,所以N2O分解速率与I2的浓度有关, D项错误;
答案选AC。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下列实验现象与实验操作不相匹配的是
实验操作 | 实验现象 | |
A | 向盛有高锰酸钾酸性溶液的试管中通入足量的乙烯后静置 | 溶液的紫色逐渐褪去,静置后溶液分层 |
B | 将镁条点燃后迅速伸入集满CO2的集气瓶 | 集气瓶中产生浓烟并有黑色颗粒产生 |
C | 向盛有饱和硫代硫酸钠溶液的试管中滴加稀盐酸 | 有刺激性气味气体产生,溶液变浑浊 |
D | 向盛有FeCl3溶液的试管中加过量铁粉,充分振荡后加1滴KSCN溶液 | 黄色逐渐消失,加KSCN后溶液颜色不变 |
A. AB. BC. CD. D