题目内容
【题目】以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN);通过电解法可制取铝.电解铝时阳极产生的CO2可通过二氧化碳甲烷化再利用. 请回答:
(1)已知:2Al2O3(s)═4Al(g)+3O2(g)△H1=3351KJmol﹣12C(s)+O2(g)═2CO(g)△H2=﹣221KJmol﹣1
2Al(g)+N2(g)═2AlN(s)△H3=﹣318KJmol﹣1
碳热还原Al2O3合成AlN的总热化学方程式是 , 该反应自发进行的条件 .
(2)在常压、Ru/TiO2催化下,CO2和H2混和气体(体积比1:4,总物质的量a mol)进行反应,测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4或CO的百分比). 反应ⅠCO2(g)+4H2(g)CH4(g)+2H2O(g)△H4
反应ⅡCO2(g)+H2(g)CO(g)+H2O(g)△H5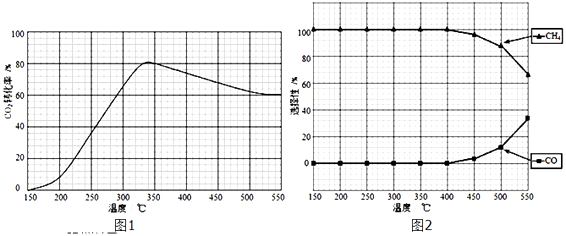
①下列说法不正确的是
A.△H4小于零
B.温度可影响产物的选择性
C.CO2平衡转化率随温度升高先增大后减少
D.其他条件不变,将CO2和H2的初始体积比改变为1:3,可提高CO2平衡转化率
②350℃时,反应Ⅰ在t1时刻达到平衡,平衡时容器体积为VL该温度下反应Ⅰ的平衡常数为(用a、V表示)
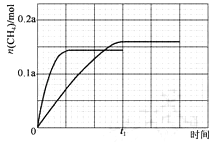
③350℃下CH4物质的量随时间的变化曲线如图3所示.画出400℃下0~t1时刻CH4物质的量随时间的变化曲线. 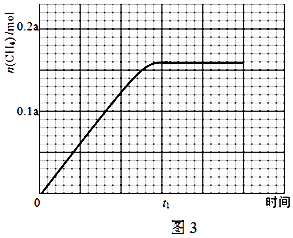
(3)据文献报道,CO2可以在碱性水溶液中电解生成甲烷,生成甲烷的电极反应式是 .
【答案】
(1)3C(s)+Al2O3(s)+N2(g)=2AlN(s)+3CO(g)△H=+2052KJ/mol/L;高温
(2)CD;![]() ;
;
(3)CO2+6H2O+8e﹣═CH4+8OH﹣
【解析】解:(1)①2Al2O3(s)═4Al(g)+3O2(g)△H1=3351KJmol﹣1②2C(s)+O2(g)═2CO(g)△H2=﹣221KJmol﹣1
③2Al(g)+N2(g)═2AlN(s)△H3=﹣318KJmol﹣1
盖斯定律计算,(①+②×3+③×2)× ![]() 得到,
得到,
碳热还原Al2O3合成AlN的总热化学方程式:3C(s)+Al2O3(s)+N2(g)=2AlN(s)+3CO(g)△H=+2052KJ/mol/L,反应△S>0,△H>0,则满足△H﹣T△S<0,反应自发进行的条件是高温条件下,
所以答案是:3C(s)+Al2O3(s)+N2(g)=2AlN(s)+3CO(g)△H=+2052KJ/mol/L;高温;(2)①A.图象中,二氧化碳先增大是反应正向进行,到一定温度达到平衡状态,升温平衡逆向进行,二氧化碳转化率随温度升高减小,平衡说明正反应为放热反应,△H4小于零,故A正确;
B.图象2分析可知,图象变化趋势随温度升高到400°C以上,CH4和CO选择性受温度影响甲烷减小,一氧化碳增大,温度可影响产物的选择性,故B正确;
C.二氧化碳转化率先增大是反应正向进行未达到平衡状态,达到平衡状态,随温度升高二氧化碳转化率减小,故C错误;
D.CO2和H2混和气体(体积比1:4,总物质的量a mol)进行反应,将CO2和H2的初始体积比改变为1:3,二氧化碳转化率减小,故D错误;
所以答案是:CD;
②在常压、Ru/TiO2催化下,CO2和H2混和气体(体积比1:4,总物质的量a mol)进行反应,350℃时,反应Ⅰ在t1时刻达到平衡,平衡时容器体积为VL,二氧化碳转化率为80%
CO2(g)+ | 4H2(g) | CH4(g)+ | 2H2O(g) | |
起始量(mol) | 0.2a | 0.8a | 0 | 0 |
变化量(mol) | 0.16a | 0.64a | 0.16a | 0.32a |
平衡量(mol) | 0.04a | 0.16a | 0.16a | 0.32a |
平衡常数K= 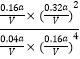 =
= ![]() ,
,
所以答案是: ![]() ;
;
③反应为放热反应,升温平衡逆向进行,二氧化碳转化率减小,图中分析可知接近72.5%,甲烷物质的量减小小于350°C时甲烷物质的量,达到平衡所需要时间缩短
CO2(g)+ | 4H2(g) | CH4(g)+ | 2H2O(g) | |
起始量(mol) | 0.2a | 0.8a | 0 | 0 |
变化量(mol) | 0.145a | 0.58a | 0.145a | 0.29a |
平衡量(mol) | 0.055a | 0.22a | 0.145a | 0.29a |
画出图象,达到平衡状态甲烷 0.145a mol,升温加快反应速率,达到平衡所需时间缩短,得到图象为 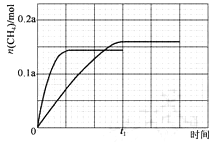 ,
,
所以答案是:  ;(3)CO2可以在碱性水溶液中电解生成甲烷,结合电荷守恒和原子守恒,用氢氧根离子浓度配平电荷守恒得到电极反应为:CO2+6H2O+8e﹣═CH4+8OH﹣ ,
;(3)CO2可以在碱性水溶液中电解生成甲烷,结合电荷守恒和原子守恒,用氢氧根离子浓度配平电荷守恒得到电极反应为:CO2+6H2O+8e﹣═CH4+8OH﹣ ,
所以答案是:CO2+6H2O+8e﹣═CH4+8OH﹣ .

【题目】根据题意填空
(1)写出H2C2O4与KMnO4酸性溶液反应的化学方程式.
(2)若要测定此反应的化学反应速率,最方便的测定方法是测定;
基于此,在实验时H2C2O4与KMnO4初始物质的量需要满足的关系为n(H2C2O4):n (KMnO4)≥ .
(3)为研究温度、浓度对此反应速率的影响,请完成以下表格
编号 | 0.1mol/L H2C2O4 溶液的体积/mL | 0.01mol/L 酸性 KMnO4 的体积/mL | 蒸馏水的体积/mL | 温度/℃ |
① | 2 | 4 | 2 | 25 |
② | 3 | |||
③ | 50 |