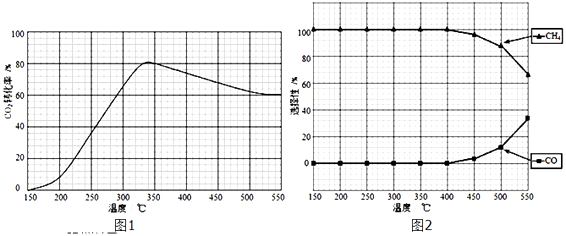
题目内容
【题目】A是天然气的主要成分,以A为原料在一定条件下可获得有机物B、C、D、E、F,其相互转化关系如图.已知烃B在标准状况下的密度为1.16gL﹣1 , C能发生银镜反应,F为有浓郁香味,不易溶于水的油状液体. 
请回答:
(1)有机物D中含有的官能团名称是 .
(2)D+E→F的反应类型是 .
(3)有机物A在高温下转化为B的化学方程式是 .
(4)下列说法正确的是 .
A.有机物E与金属钠反应比水与金属钠反应要剧烈
B.有机物D、E、F可用饱和Na2CO3溶液鉴别
C.实验室制备F时,浓硫酸主要起氧化作用
D.有机物C能被新制碱性氢氧化铜悬浊液、酸性KMnO4溶液氧化.
【答案】
(1)酯基
(2)酯化反应
(3)2CH4 ![]() CH2=CH2+H2
CH2=CH2+H2
(4)BD
【解析】解:A是天然气的主要成分,则A为CH4;已知烃B在标准状况下的密度为1.16gL﹣1 , 则B的摩尔质量为:M(B)=22.4L/mol×1.16gL﹣1≈26g/mol;C能发生银镜反应,则C分子中含有醛基;F为有浓郁香味,不易溶于水的油状液体,则F为酯,根据转化关系可知F为CH3COOC2H5;C催化氧化得D,C与氢气发生还原反应生成E,则D为CH3COOH、E为CH3CH2OH、C为CH3CHO;B与水反应生成乙醛,且B的摩尔质量为26g/mol,则B为CH2=CH2 , (1)D的结构简式为D为CH3COOH,其含有官能团为酯基, 所以答案是:酯基;(2)D为CH3COOH、E为CH3CH2OH,二者在浓硫酸存在条件下发生酯化反应生成乙酸乙酯,
所以答案是:酯化反应;(3)A为CH4 , B为乙烯,CH4在高温下转化为乙烯的化学方程式是:2CH4 ![]() CH2=CH2+H2 ,
CH2=CH2+H2 ,
所以答案是:2CH4 ![]() CH2=CH2+H2;(4)A.E为CH3CH2OH,乙醇与金属钠反应不如水与金属钠反应剧烈,故A错误;
CH2=CH2+H2;(4)A.E为CH3CH2OH,乙醇与金属钠反应不如水与金属钠反应剧烈,故A错误;
B.D为CH3COOH、E为CH3CH2OH、F为CH3COOC2H5 , 乙酸与碳酸钠生成气体,乙酸乙酯不溶于饱和碳酸钠溶液,乙醇易溶于碳酸钠溶液,所以可用饱和Na2CO3溶液鉴别三者,故B正确;
C.实验室制备乙酸乙酯时,浓硫酸为催化剂和吸水剂,不体现氧化性,故C错误;
D.有机物C为CH3CHO,CH3CHO中含有官能团醛基,醛基能被新制碱性氢氧化铜悬浊液、酸性KMnO4溶液氧化,故D正确;
所以答案是:BD.

【题目】C、N、O、Al、Si、Cu是常见的六种元素.
(1)Si位于元索周期表第周期第族.
(2)N原子的原子结构示意图为;Cu的低价氧化物的颜色为 .
(3)用“>”或“<”填空:
原子半径 | 电负性 | 熔点 | 沸点 |
AlSi | NO | 金刚石晶体硅 | CH4SiH4 |
(4)常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生. 
0﹣t1时,原电池的负极是Al片,此时,正极的电极反应式是 , 溶液中的H+向极移动,t1时,原电池中电子流动方向发生改变,其原因是 .