题目内容
化学肥料在农业生产中具有重要的作用,关系着农业生产是否丰收。化学肥料在农业生产中的广泛应用,为化学肥料的大规模工业生产提供了舞台。
(1)在合成氨的设备(合成塔)中,设置热交换器的目的是______________。
(2)生产硝酸的过程中常会产生一些氮的氧化物,一般可采用下列两种方法处理。
碱液吸收法:NO+NO2+2NaOH=2NaNO2+H2O
氨还原法:8NH3+6NO2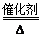 7N2+12H2O(NO也有类似的反应)
7N2+12H2O(NO也有类似的反应)
请从绿色化学的角度分析两种方法的优劣:____________________。
(3)某化肥厂用NH3制备NH4NO3。已知:由NH3制NO的产率是96%,NO制HNO3的产率是92%,则制HNO3所用去的NH3的质量占总耗用NH3质量(不考虑其他损耗)的________%。
(4)硝酸铵是一种常用的氮肥,在贮存和使用该化肥时,把应注意的事项及理由填入下表(填两条应注意的事项及理由即可)。
(1)在合成氨的设备(合成塔)中,设置热交换器的目的是______________。
(2)生产硝酸的过程中常会产生一些氮的氧化物,一般可采用下列两种方法处理。
碱液吸收法:NO+NO2+2NaOH=2NaNO2+H2O
氨还原法:8NH3+6NO2
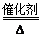 7N2+12H2O(NO也有类似的反应)
7N2+12H2O(NO也有类似的反应)请从绿色化学的角度分析两种方法的优劣:____________________。
(3)某化肥厂用NH3制备NH4NO3。已知:由NH3制NO的产率是96%,NO制HNO3的产率是92%,则制HNO3所用去的NH3的质量占总耗用NH3质量(不考虑其他损耗)的________%。
(4)硝酸铵是一种常用的氮肥,在贮存和使用该化肥时,把应注意的事项及理由填入下表(填两条应注意的事项及理由即可)。
| | 注意事项 | 理由 |
| ① | ______________ | ____________ |
| ② | ________________ | ____________ |
(1)利用余热,节约能源
(2)碱液吸收法要消耗大量的NaOH,同时产生有毒的NaNO2,但可以生产副产品“工业盐(NaNO2)”;氨还原法不消耗贵重原料,且产物无污染,但氮的氧化物被浪费了
(3)53.1
(4)①不能与碱性肥料混施 硝酸铵溶液呈酸性 ②不能剧烈撞击 硝酸铵易爆炸 ③不能在雨水较多的地区使用 硝酸铵吸水性强,易流失(答出任意两条即可)
(2)碱液吸收法要消耗大量的NaOH,同时产生有毒的NaNO2,但可以生产副产品“工业盐(NaNO2)”;氨还原法不消耗贵重原料,且产物无污染,但氮的氧化物被浪费了
(3)53.1
(4)①不能与碱性肥料混施 硝酸铵溶液呈酸性 ②不能剧烈撞击 硝酸铵易爆炸 ③不能在雨水较多的地区使用 硝酸铵吸水性强,易流失(答出任意两条即可)
试题分析:(1)热交换器可以把合成氨时放出的热量转移出来,既降低了反应体系的温度,又能使余热得以充分利用。
(2)氮的氧化物的“碱液吸收法”和“氨还原法”各有优劣,前者消耗烧碱,且产物有毒,但可生产“工业盐”;后者消耗氨气,产物无毒,但使氮的氧化物白白浪费。
(3)硝酸铵中硝态氮和铵态氮的量相等,但由氨气生产硝态氮的过程中出现了损失,假设硝酸铵中硝态氨和铵态氮各为1,则生产硝态氮需要的氨为
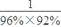 =1.13,所以制HNO3所用去的NH3的质量点总耗用NH3质量的百分比为
=1.13,所以制HNO3所用去的NH3的质量点总耗用NH3质量的百分比为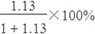 =53.1%。
=53.1%。(4)①硝酸铵为强酸弱碱盐,水解显酸性,,所以不能与碱性肥料混施。
②硝酸铵撞击时分解,容易爆炸,所以不能剧烈撞击;硝酸铵吸水性强,易流失,所以不能在雨水较多的地区使用。

练习册系列答案
相关题目
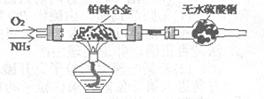
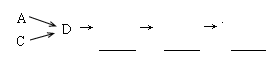
 3Cu+N2+3H2O),而氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水立即反应生成Mg(OH)2和NH3。乙组提出了如下制备氮化镁的实验方案示意框图(实验前系统内空气已排除;图中箭头表示气体的流向)。你认为此方案是否正确,并说明理由 。
3Cu+N2+3H2O),而氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水立即反应生成Mg(OH)2和NH3。乙组提出了如下制备氮化镁的实验方案示意框图(实验前系统内空气已排除;图中箭头表示气体的流向)。你认为此方案是否正确,并说明理由 。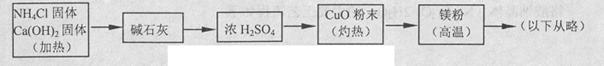
 2NH3(g) ΔH<0,其他条件不变时升高温度,平衡时氢气转化率增大
2NH3(g) ΔH<0,其他条件不变时升高温度,平衡时氢气转化率增大