题目内容
下列各表述与示意图一致的是( )
A.图①表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的量与NaOH的体积的关系图.则三种离子的物质的量之比为:n(Mg2+):n(Al3+):n(NH4+)=2:3:2
B.图①中使用的NaOH的浓度为2mol/L
C.图②表示25℃时,用0.1mol?L-1盐酸滴定20mL0.1mol?L-1NaOH溶液,溶液的pH随加入酸体积的变化
D.图③中曲线表示3N2(g)+N2(g)
 2NH3(g)反应过程的能量变化.若使用催化剂,B点会升高
2NH3(g)反应过程的能量变化.若使用催化剂,B点会升高
【答案】分析:图①涉及到的离子方程式有:Mg2++2OH-═Mg(OH)2↓,Al3++3OH-═Al(OH)3↓,NH4++OH-═NH3?H2O,
Al(OH)3+OH-═AlO2-+2H2O,设NaOH溶液的浓度为xmol/L,则n(NH4+)=0.01xmol,n(Al(OH)3)=n(Al3+)=0.005xmol,
n(Mg2+)=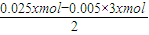 =0.005xmol,则:n(Mg2+):n(Al3+):n(NH4+)=1:1:2,
=0.005xmol,则:n(Mg2+):n(Al3+):n(NH4+)=1:1:2,
根据氢氧化镁的物质的量可知:0.005xmol=0.05mol,x=10mol/L;
图②中加入盐酸体积为20ml时酸碱中和,PH=7;中和后继续加入盐酸,PH减小,溶液呈酸性;
图③中曲线表示反应物和生成物的能量的大小,如A是反应物,则反应放热,反之吸热,B点为活化能,加入催化剂,活化能降低.
解答:解:A、图①涉及到的离子方程式有:Mg2++2OH-═Mg(OH)2↓,Al3++3OH-═Al(OH)3↓,NH4++OH-═NH3?H2O,
Al(OH)3+OH-═AlO2-+2H2O,设NaOH溶液的浓度为xmol/L,则n(NH4+)=0.01xmol,n(Al(OH)3)=n(Al3+)=0.005xmol,
nn(Mg2+)=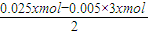 =0.005xmol,则:n(Mg2+):n(Al3+):n(NH4+)=1:1:2,故A错误;
=0.005xmol,则:n(Mg2+):n(Al3+):n(NH4+)=1:1:2,故A错误;
B、设NaOH溶液的浓度为xmol/L,根据n(Mg2+)=n(Mg(OH)2)=0.005xmol=0.05mol,x=10mol/L,故B错误;
C、图②中25℃时,用0.1mol?L-1盐酸滴定20mL0.1mol?L-1NaOH溶液,加入盐酸体积为20ml时酸碱中和,PH=7,中和后继续加入盐酸,PH减小,溶液呈酸性,故C正确;
D、③中曲线表示反应物和生成物的能量的大小,如A是反应物,则反应放热,反之吸热,B点为活化能,加入催化剂,活化能降低,故D错误.
故选C.
点评:本题考查离子浓度的计算以及酸碱中和滴定等知识,本题难度较大,注意分析图象和氢氧化铝的两性等问题.
Al(OH)3+OH-═AlO2-+2H2O,设NaOH溶液的浓度为xmol/L,则n(NH4+)=0.01xmol,n(Al(OH)3)=n(Al3+)=0.005xmol,
n(Mg2+)=
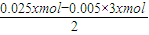 =0.005xmol,则:n(Mg2+):n(Al3+):n(NH4+)=1:1:2,
=0.005xmol,则:n(Mg2+):n(Al3+):n(NH4+)=1:1:2,根据氢氧化镁的物质的量可知:0.005xmol=0.05mol,x=10mol/L;
图②中加入盐酸体积为20ml时酸碱中和,PH=7;中和后继续加入盐酸,PH减小,溶液呈酸性;
图③中曲线表示反应物和生成物的能量的大小,如A是反应物,则反应放热,反之吸热,B点为活化能,加入催化剂,活化能降低.
解答:解:A、图①涉及到的离子方程式有:Mg2++2OH-═Mg(OH)2↓,Al3++3OH-═Al(OH)3↓,NH4++OH-═NH3?H2O,
Al(OH)3+OH-═AlO2-+2H2O,设NaOH溶液的浓度为xmol/L,则n(NH4+)=0.01xmol,n(Al(OH)3)=n(Al3+)=0.005xmol,
nn(Mg2+)=
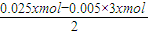 =0.005xmol,则:n(Mg2+):n(Al3+):n(NH4+)=1:1:2,故A错误;
=0.005xmol,则:n(Mg2+):n(Al3+):n(NH4+)=1:1:2,故A错误;B、设NaOH溶液的浓度为xmol/L,根据n(Mg2+)=n(Mg(OH)2)=0.005xmol=0.05mol,x=10mol/L,故B错误;
C、图②中25℃时,用0.1mol?L-1盐酸滴定20mL0.1mol?L-1NaOH溶液,加入盐酸体积为20ml时酸碱中和,PH=7,中和后继续加入盐酸,PH减小,溶液呈酸性,故C正确;
D、③中曲线表示反应物和生成物的能量的大小,如A是反应物,则反应放热,反之吸热,B点为活化能,加入催化剂,活化能降低,故D错误.
故选C.
点评:本题考查离子浓度的计算以及酸碱中和滴定等知识,本题难度较大,注意分析图象和氢氧化铝的两性等问题.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
下列各表述与示意图一致的是( )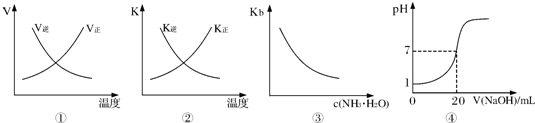

| A、图①表示反应N2(g)+O2(g)?2NO(g)△H>0正、逆反应的速率随温度的变化 | B、图②表示反应N2(g)+3H2(g)?2NH3(g)△H<0正、逆反应的平衡常数随温度的变化 | C、图③表示氨水的电离平衡常数随氨水浓度c(NH3?H2O)的变化 | D、图④表示25℃时,用0.1mol?L-1NaOH溶液滴定20mL 0.lmol?L-1盐酸,溶液的pH随加入碱体积的变化 |
室温时,下列各表述与示意图一致的是( )
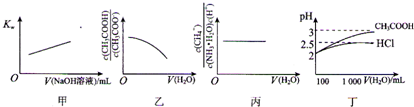

| A、图甲表示在纯水中加入0.01 moL?L-1 NaOH溶液,Kw与NaOH溶液体积变化关系 | ||
B、图乙表示将1 mol?L-1 CH3COONa溶液加水稀释,溶液中
| ||
C、图丙表示0.1mol?L-1 NH3?H2O加水稀释,溶液中
| ||
| D、图丁表示100 mL pH=2的HCl和CH3COOH加水稀释到1000mL时pH变化与水的体积的变化关系 |


