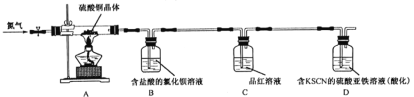
题目内容
【题目】为了探究和验证氯气的性质,某研究性学习小组以MnO2和浓盐酸为主要原料,设计了如图所示装置(其中a是连有注射器针头的橡皮管,针头已插入并穿过橡皮塞)进行了研究。
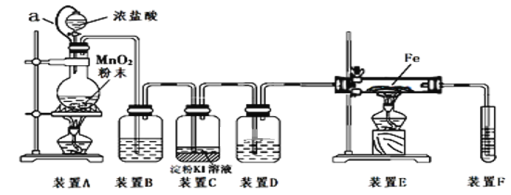
(资料:氯气与铁反应制取氯化铁要在无水条件下进行)
试回答下列问题:
(l)装置A中发生反应的化学方程式为_____________________。
(2)装置B中的试剂为_________,装置D作用是________。
(3)装置C中发生反应的离子方程式为_____________________________。
(4)反应开始后,装置E发生反应的化学方程式为____________________________。
(5)装置F中发生反应的化学方程式为________________________。
【答案】MnO2+4HCl(浓)![]() MnCl2+Cl2↑+H2O 饱和食盐水 干燥氯气/吸收水分 2I-+Cl2=2Cl-+I2 2Fe+3Cl2
MnCl2+Cl2↑+H2O 饱和食盐水 干燥氯气/吸收水分 2I-+Cl2=2Cl-+I2 2Fe+3Cl2![]() 2FeCl3 2NaOH+Cl2=NaCl+NaClO+H2O
2FeCl3 2NaOH+Cl2=NaCl+NaClO+H2O
【解析】
(1)在加热的条件下二氧化锰氧化浓盐酸生成氯气,根据原子守恒书写方程式;
(2)根据生成的氯气中含有水蒸气和氯化氢分析解答;
(3)根据氯气能氧化碘化钾生成碘和氯化钾书写;
(4)氯气和铁反应生成氯化铁,据此解答;
(5)根据氯气有毒需要尾气处理分析。
(l)在加热的条件下二氧化锰和浓盐酸反应生成氯化锰、氯气和水,则装置A中发生反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+H2O。
MnCl2+Cl2↑+H2O。
(2)氯气与铁反应制取氯化铁要在无水条件下进行,而反应生成的氯气中含有氯化氢和水蒸气杂质气体,氯化氢极易溶于水,氯气在饱和食盐水中溶解性很小,通过饱和食盐水除去氯化氢气体,通过浓硫酸吸收水蒸气,装置B中盛放的试剂是饱和食盐水,目的是吸收氯气中混有的杂质HCl,装置D中盛放的液体是浓硫酸,目的是吸收水蒸气,干燥氯气。
(3)氯气具有强氧化性,能把碘化钾氧化为单质碘,则装置C中发生反应的离子方程式为2I-+Cl2=2Cl-+I2。
(4)在加热的条件下氯气和铁反应生成氯化铁,则反应开始后,装置E发生反应的化学方程式为2Fe+3Cl2![]() 2FeCl3;
2FeCl3;
(5)氯气有毒,不能排放到空气中,装置F中盛放的是氢氧化钠溶液,用来吸收未反应的氯气,防止污染空气,氯气与NaOH溶液反应的化学方程式是2NaOH+Cl2=NaCl+NaClO+H2O。