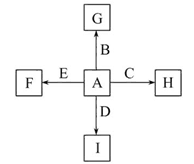
题目内容
将0.1mol的镁铝混合物溶于100ml 2mol/L的H2SO4中,然后滴加1mol/L的NaOH溶液,请回答:
(1)若在滴加NaOH溶液的过程中,生成沉淀的质量m与加入NaOH溶液的体积关系如图所示。请回答:当V1=160mL时,则金属粉末中n(Mg)=_____mol,V2=______mL。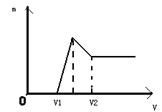
(2)若在滴加NaOH溶液的过程中欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液体积为________ml
(3)若混合物仍为0.1mol其中镁粉的物质的量的分数为a,用100ml2mol/L的硫酸溶解此混合物后再加入450ml1mol/L的氢氧化钠溶液,所得沉淀中无Al(OH)3。满足此条件a的取值范围是__ ___。
(1)0.06 440 (2)400 (3)1/2 ≤a<1
解析试题分析:(1)当V1=160mL时,此时,溶液是MgSO4、Al2(SO4)3和Na2SO4混合液,由Na+离子守恒可知,n(Na2SO4)=1/2n(NaOH)=1/2×0.16L×1mol/L=0.08mol,令MgSO4为xmol,Al2(SO4)3为ymol,则:根据Mg原子、Al原子守恒有:x+2y=0.1根据SO42-离子守恒有:x+3y=0.1×2-0.08,联立方程,解得:x=0.06、y=0.02所以金属粉末中n(Mg)=0.06mol,n(Al)=2y=2×0.02mol=0.04mol,
滴加NaOH溶液到体积V2时,溶液是Na2SO4和NaAlO2混合液,根据守恒有:n(NaOH)=2n(Na2SO4)+n(NaAlO2)=2n(H2SO4)+n(Al)=2×0.1L×2mol/L×+0.04mol=0.44mol,所以,V2=0.44mo l/1mol/L
=0.44L=440ml;(2)当溶液中Mg2+、Al3+恰好沉淀完全时,此时溶液是Na2SO4溶液,根据SO42-离子和Na+离子守恒有:n(Na+)=2n(Na2SO4)=2(H2SO4)=2×0.1L×2mol/L=0.4mol,所以,V(NaOH)=0.4mol/1mol/L=0.4L=400ml;(3)由于为金属混合物,则a<1,Al的物质的量为0.1(1-a)mol,反应后的混合溶液,再加入450mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3,溶质为硫酸钠、偏铝酸钠,根据铝元素守恒可知n(NaAlO2)=0.1(1-a)mol,根据钠离子守恒,应满足n(NaOH)≥2n(Na2SO4)+n(NaAlO2),即0.45×1≥2×0.1×2+0.1(1-a),解得a≥0.5,故0.5≤a<1。
考点:有关混合物反应的计算;镁的化学性质;铝的化学性质。

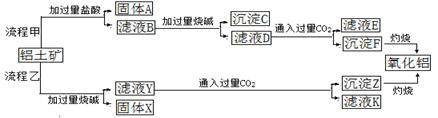
工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下: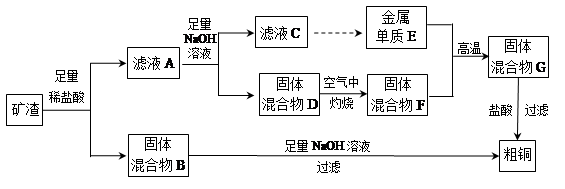
已知:Cu2O+2H+═Cu+Cu2++H2O
(1)固体混合物B与氢氧化钠溶液反应的化学方程式为 。
(2)滤液A中铁元素的存在形式只能为Fe2+,理由是
。涉及的离子方程式为 、
(不必书写Cu2O与盐酸的反应)。检验滤液A中Fe2+的试剂为 (填试剂名称)。
(3)将滤液C中的铝元素以沉淀形式析出,可选用的最佳试剂为 __ (填序号)。
| A.氢氧化钠溶液 | B.硫酸溶液 | C.氨水 | D.二氧化碳 |
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下: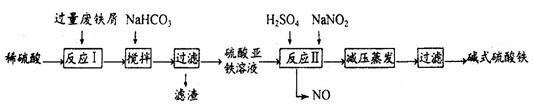
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
(1)反应I溶液中存在的金属阳离子有__________________。
(2)加入NaHCO3的目的是调节pH,使溶液中的______(填“Fe3+”、“Fe2+”或“A13+”)沉淀。该工艺流程中“搅拌”的作用是_____________。
(3)反应II的离子方程式为__________。在实际生产中,反应II常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作为________。若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2物质的量为__________。
(4)碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子。该水解反应的离子方程式为__________________________。
 B+H能放出大量的热,该反应曾应用于铁轨的焊接;
B+H能放出大量的热,该反应曾应用于铁轨的焊接; 2F+D,F中E元素的质量分数为60%。
2F+D,F中E元素的质量分数为60%。