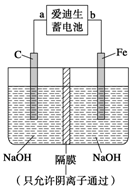
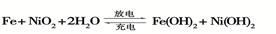题目内容
如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物。已知:
①反应C+G B+H能放出大量的热,该反应曾应用于铁轨的焊接;
B+H能放出大量的热,该反应曾应用于铁轨的焊接;
②I是一种常见的温室气体,它和E可以发生反应:2E+I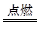 2F+D,F中E元素的质量分数为60%。
2F+D,F中E元素的质量分数为60%。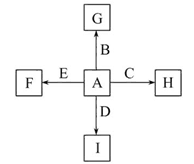
回答问题:
(1)①中反应的化学方程式为:________________________________________;
(2)1.6 g G溶于盐酸,得到的溶液与铜粉完全反应,计算至少需铜粉的质量(写出离子方程式和计算过程);__________________________________________。
(3)C与过量NaOH溶液反应的离子方程式为:___________________________,反应后溶液与过量化合物I反应的离子方程式为:_________________________;
(4)E在I中燃烧观察到的现象是:____________________________________。
(1)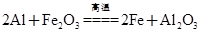
(2)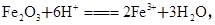
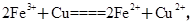
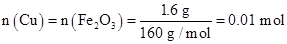 ,至少需铜粉的质量为0.01 mol×64 g/mol="0.64" g
,至少需铜粉的质量为0.01 mol×64 g/mol="0.64" g
(3)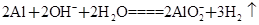
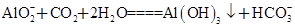
(4)镁条剧烈燃烧,生成白色粉末,反应器内壁附着黑色固体
解析

练习册系列答案
 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
从含有Ag+、Fe3+和Al3+的溶液中,按下图所示方法分离提取金属单质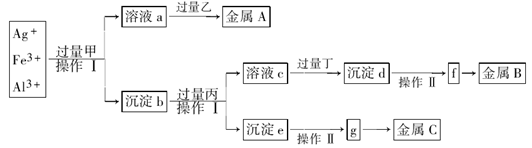
已知:实验时甲、乙、丙、丁四种物质只能从碳酸铵、氢氧化钠、稀硫酸、葡萄糖四种溶液中选择,也可用这四种溶液来制取。对该实验过程的分析正确的是
| A.丙是NaOH,丁是稀H2SO4 |
| B.乙是葡萄糖,利用乙的还原性将金属A从溶液a中还原出来 |
| C.操作I是过滤和洗涤沉淀。洗涤沉淀的方法是将漏斗中的沉淀转移到小烧杯中,加蒸馏水浸没沉淀,用玻璃棒搅拌,然后将水倒出,重复2-3次 |
| D.g是氧化物,金属c采用电解法获得 |
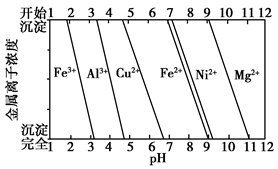

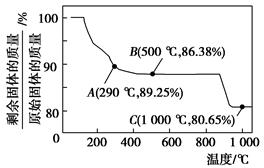
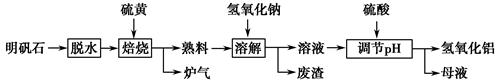
 Al2(SO4)3+
Al2(SO4)3+