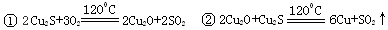题目内容
某工厂的废金属屑中主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,该厂用上述废金属屑制取新型高效水处理剂Na2FeO4(高铁酸钠)等产品,过程如下:
I.向废金属屑中加入过量的NaOH溶液,充分反应后过滤;
II.向I所得固体中加入过量稀H2SO4,充分反应后过滤;
III.向II所得固体中继续加入热的稀H2SO4,同时不断鼓入空气,固体溶解得CuSO4溶液;
IV.(1)步骤I中发生反应的化学方程式为 、 。
(2)步骤II所得的滤液中加入KSCN溶液无明显现象,表明滤液中不存在Fe3+,用离子方程式解释其
可能的原因 。
(3)步骤III获得CuSO4溶液的离子方程式为 。
(4)步骤II所得滤液经进一步处理可制得Na2FeO4,流程如下:
①测得滤液中c(Fe2+) 为a mol·L-1,若要处理1 m3滤液,理论上需要消耗25 % 的H2O2溶液_________kg
(用含a的代数式表示)。
②写出由Fe(OH)3制取Na2FeO4的化学方程式___________。
(1)2Al+2H2O+2NaOH=2NaAlO2+3H2↑(2分)
Al2O3+2NaOH=2NaAlO2+H2O(2分)
(2) 2Fe3++Fe=3Fe2+ (或2Fe3++Cu=2Fe2++Cu2+或Fe+Fe2O3+6H+=3Fe2++3 H2O等)(1分)
(3)2Cu+O2+4H+  2Cu2++2H2O(2分)
2Cu2++2H2O(2分)
(4) ① 68 a(2分)
②2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O (2分)
解析试题分析:(1)废金属屑中能和氢氧化钠溶液反应的物质是金属铝和两性氧化物氧化铝,所以反应的化学方程式为2Al+2H2O+2NaOH=2NaAlO2+3H2↑、Al2O3+2NaOH=2NaAlO2+H2O。
(2)I所得固体中含有铁、铜和氧化铁,加入过量稀H2SO4后铁、氧化铁被溶解分别生成硫酸亚铁和硫酸铁。由于铁离子具有氧化性,能氧化单质铜生成铜离子和亚铜离子,所以加入KSCN溶液后不显红色,反应的离子方程式为2Fe3++Fe=3Fe2+。
(3)铜与稀硫酸不反应,但在加热的条件下能被空气中的氧气氧化生成氧化铜,氧化铜可以溶解在稀硫酸中生成硫酸铜,反应的化学方程式为2Cu+O2+4H+  2Cu2++2H2O。
2Cu2++2H2O。
(4)①滤液中亚铁离子的物质的量是1000amol,生成氢氧化铁失去1000amol电子。双氧水在反应中氧元素的化合价从-1价降低到-2价,得到1个电子,因此1mol双氧水在反应中得到2mol电子。设需要双氧水溶液的质量是m,则根据电子得失守恒可知,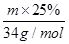 ×2=1000amol,解得m=68000amg=68amkg。
×2=1000amol,解得m=68000amg=68amkg。
②铁元素的化合价从+3价升高到+6价失去3个电子,次氯酸钠中氯元素的化合价从+1价降低到-1 价,得到2个电子。因此根据电子得失守恒可知还原剂与氧化剂的物质的量之比=2:3。根据原子守恒可知,反应中还有水生成,所以反应的化学方程式为2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O。
考点:考查金属铝、铁和铜以及化合物性质、高铁酸钠的制备、氧化还原反应的计算等

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案某研究性学习小组对铝热反应实验展开研究。现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | -- |
Ⅰ.某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。
你认为他的解释是否合理?答:__________(填“合理”或“不合理”)
(1)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是 ,
反应的离子方程式为 。
(2)实验室溶解该熔融物,下列试剂中最好的是 (填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
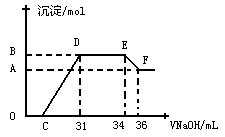
(3)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为__________
(4)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为__________
(5)上述现象说明溶液中________________结合OH-的能力比________强(填离子符号)。
(6)B点对应的沉淀的物质的量为________mol,C点对应的氢氧化钠溶液的体积为_______mL。
Fe2O3具有广泛的用途。甲同学阅读有关资料得知:在高温下煅烧FeCO3可以得到Fe2O3。为了进一步验证此结论,他做了如下实验:
| 实验步骤 | 实验操作 |
| Ⅰ | 取一定质量的FeCO3固体置于坩埚中,高温煅烧至质量不再减轻,冷却至室温 |
| Ⅱ | 取少量实验步骤I所得固体放于一洁净的试管中,用足量的稀硫酸溶解 |
| Ⅲ | 向实验步骤Ⅱ所得溶液中滴加KSCN溶液,溶液变红 |
由此甲同学得出结论:4FeCO3+O2
 2Fe2O3+4CO2
2Fe2O3+4CO2(1)写出实验步骤Ⅲ中发生反应的离子方程式__________________________________。
(2)乙同学提出了不同的看法:煅烧产物可能是Fe3O4,因为Fe3O4也可以溶于硫酸,且所得溶液中也含有Fe3+。于是乙同学对甲同学的实验步骤Ⅲ进行了补充改进:检验实验步骤Ⅱ所得溶液中是否含有Fe2+。他需要选择的试剂是____________(填序号)。
a.氯水 b.氯水+KSCN溶液 c.K3[Fe(CN)6](铁氰化钾溶液)
(3)丙同学认为即使得到了乙同学预期的实验现象,也不能确定煅烧产物的成分。你认为丙同学持此看法的理由是____________。
(4)丙同学进一步查阅资料得知,煅烧FeCO3的产物中的确含有+2价铁元素。于是他设计了另一种由FeCO3制取Fe2O3的方法:先向FeCO3中依次加入试剂:稀硫酸、________ (填试剂名称)和氨水;再_________(填操作名称),灼烧,即可得到Fe2O3。
(5)工业上用氧化还原滴定法测菱铁矿中FeCO3的质量分数,通过控制样品的质量,使滴定时消耗KMnO4溶液体积为c mL,对应菱铁矿中FeCO3的质量分数为c%,可以简化计算。某同学取含FeCO3 c%的菱铁矿a g,用足量稀硫酸溶解后,再用0.0 200 mol·L-1的酸性KMnO4溶液滴定(KMnO4被还原成Mn2+),最终消耗KMnO4溶液c mL。假定矿石中无其他还原性物质,则所取菱铁矿的质量a=__________g。(FeCO3的摩尔质量为116 g·mol-1)
用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O,工艺流程如下(部分操作和条件略):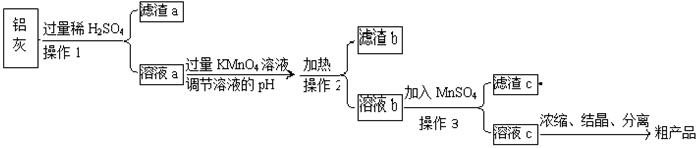
(1)滤渣a可用于制造 。
(2)请将MnO4-氧化Fe2+的离子方程式补充完整:
若反应中转移了2mol电子,则消耗氧化剂的物质的量为 mol。
(3)已知生成氢氧化物沉淀的pH如下:
| | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
调节溶液pH约为3的目的是: 。
(4)取少量滤渣C于试管中,加入适量的双氧水,产生能使带火星小木条复燃的气体,说明滤渣C的主要成分是 。请写出加入MnSO4时所发生反应的离子方程式: 。
(5)A12(SO4)3·18H2O溶于水溶液呈酸性的原因: 。(用离子方程式表示)