题目内容
某同学用一小块铝片和盐酸反应制取H2,实验现象如下表:
反应1~15min内,铝与盐酸的反应速率变化的可能原因是( )
| 时间 | 1min | 2min | 5min | 15min | 20min |
| 现象 | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
| A、该反应是放热反应,温度升高 |
| B、反应过程中盐酸的浓度增大 |
| C、随着反应的进行,铝片表面积变小 |
| D、Cl-离子是该反应的催化剂 |
考点:化学反应速率的影响因素
专题:化学反应速率专题
分析:影响铝与盐酸反应速率的因素有浓度、温度以及固体表面等,铝与盐酸的反应为放热反应,随着反应的进行,温度逐渐升高,但盐酸浓度逐渐降低,表中数据可知,反应在1~15min内是由缓慢到剧烈,结合影响因素解答该题.
解答:
解:随着反应的进行,温度逐渐升高,则反应速率逐渐增大,
盐酸浓度逐渐降低,铝片表面积变小,则反应速率逐渐减小,
Cl-离子不参加反应,不是催化剂,
只有A正确.
故选A.
盐酸浓度逐渐降低,铝片表面积变小,则反应速率逐渐减小,
Cl-离子不参加反应,不是催化剂,
只有A正确.
故选A.
点评:本题考查化学反应速率的影响,为高频考点,侧重于学生的分析能力的考查,注意把握表中数据的变化规律,难度不大.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
将纯锌片和纯铜片按如图方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )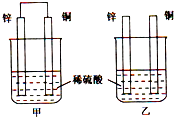

| A、两烧杯中铜片表面均无气泡产生 |
| B、甲中正极的电极反应式为Zn-2e-=Zn2+ |
| C、两烧杯中氢离子浓度均减少 |
| D、产生气泡的速度甲比乙慢 |
下列表示物质结构的化学用语或模型图正确的是( )
| A、HClO的结构式:H-Cl-O |
B、NH3分子的电子式: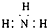 |
C、CO2的比例模型: |
D、18O的原子结构示意图: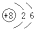 |
用加热的方法可以分离的一组物质是( )
| A、氯化铵和消石灰 |
| B、碳酸氢钠和氯化铵 |
| C、碳酸氢铵和过氧化钠 |
| D、氯化铵和氯化钠 |
下列不属于氧化还原反应的是( )
| A、2KMnO4+5SO2+2H2O═K2SO4+2MnSO4+2H2SO4 |
| B、工业制漂白粉 |
| C、氯碱工业制氯气 |
| D、Na2O2+2HCl═2NaCl+H2O2 |
对可逆反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g),下列叙述正确的是( )
| A、若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 |
| B、达到化学平衡时,4v正(O2)=5v逆(NO) |
| C、达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 |
| D、化学反应速率关系是:v(正)>v(逆) |