题目内容
11.下列有关物质用途的说法正确的是( )| A. | 明矾可用作净水剂 | B. | 甲醛可用作食品防腐剂 | ||
| C. | 氢氧化钠可用来治疗胃酸过多 | D. | 铝制容器可长期存放酸性食物 |
分析 A、根据盐类水解的生成物的性质分析;
B、甲醛有毒;
C、NaOH是强碱;
D、铝是一种活泼金属,能和酸反应.
解答 解:A、明矾是强酸弱碱盐,在水溶液里能发生水解生成氢氧化铝胶体,氢氧化铝胶体具有吸附性,所以能作净水剂,故A正确;
B、甲醛有毒,不能用于食品的防腐,只能用来浸泡标本,故B错误;
C、NaOH是强碱,有很强的刺激性,不能用来治疗胃酸过度,故C错误;
D、铝是一种活泼金属,能和酸反应,用来盛装酸性食品可对铝制容器造成腐蚀,故D错误.
故选A.
点评 本题通过考查物质在生活中的应用,充分体现了化学对人们的生活所起的巨大作用,激发学生学习化学的兴趣.

练习册系列答案
 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案
相关题目
8.下列第IA族元素中,金属元素最弱的是( )
| A. | 锂 | B. | 钠 | C. | 钾 | D. | 铷 |
2.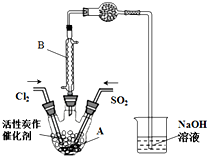 某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如表所示.
某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如表所示.
(1)若用浓盐酸与二氧化锰为原料制取Cl2,反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)B仪器的作用是使挥发的产物SO2Cl2冷凝回流.
(3)为了便于混合物的分离且提高反应物的转化率,A装置的反应条件最好选择a.
a.冰水浴 b.常温 c.加热至69.1℃
(4)如果通入的Cl2或SO2含有水蒸气,氯气和二氧化硫可能发生反应的化学方程式为SO2+Cl2+2H2O=H2SO4+2HCl.
(5)实验时先通入干燥的Cl2将A装置中的空气赶走,再缓慢通入干燥的SO2,即发生反应.充分反应后,继续通入Cl2使装置中的SO2进入烧杯中被吸收.分离产物后,向获得的SO2Cl2中加水,出现白雾,振荡、静置得到无色溶液W.
①经分析SO2Cl2与H2O反应属于非氧化还原反应,写出该反应的化学方程式SO2Cl2+2H2O=H2SO4+2HCl.
②无色溶液W中的阴离子除含少量OH-外,还含有其它两种阴离子,检验溶液W中这两种阴离子方法是取少量W溶液于试管中,加入过量Ba(NO3)2溶液,有不溶于稀硝酸的白色沉淀产生,说明溶液中含有SO42-,过滤,向滤液中滴加HNO3酸化,再加入AgNO3溶液,产生白色沉淀,则说明溶液中有Cl-.
③反应完成后,在W溶液、烧杯中分别滴加过量的BaCl2溶液,均出现白色沉淀,此沉淀不溶于稀盐酸,经过滤、洗涤、干燥,称量得到的固体质量分别为Xg、Yg.计算SO2+Cl2?SO2Cl2反应中,SO2的转化率(用含X、Y的代数式表示).
 某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如表所示.
某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如表所示.| SO2Cl2 | Cl2 | SO2 | |
| 熔点/℃ | -54.1 | -101 | -72.4 |
| 沸点/℃ | 69.1 | -34.6 | -10 |
| 性质 | 遇水发生 剧烈水解 |
(2)B仪器的作用是使挥发的产物SO2Cl2冷凝回流.
(3)为了便于混合物的分离且提高反应物的转化率,A装置的反应条件最好选择a.
a.冰水浴 b.常温 c.加热至69.1℃
(4)如果通入的Cl2或SO2含有水蒸气,氯气和二氧化硫可能发生反应的化学方程式为SO2+Cl2+2H2O=H2SO4+2HCl.
(5)实验时先通入干燥的Cl2将A装置中的空气赶走,再缓慢通入干燥的SO2,即发生反应.充分反应后,继续通入Cl2使装置中的SO2进入烧杯中被吸收.分离产物后,向获得的SO2Cl2中加水,出现白雾,振荡、静置得到无色溶液W.
①经分析SO2Cl2与H2O反应属于非氧化还原反应,写出该反应的化学方程式SO2Cl2+2H2O=H2SO4+2HCl.
②无色溶液W中的阴离子除含少量OH-外,还含有其它两种阴离子,检验溶液W中这两种阴离子方法是取少量W溶液于试管中,加入过量Ba(NO3)2溶液,有不溶于稀硝酸的白色沉淀产生,说明溶液中含有SO42-,过滤,向滤液中滴加HNO3酸化,再加入AgNO3溶液,产生白色沉淀,则说明溶液中有Cl-.
③反应完成后,在W溶液、烧杯中分别滴加过量的BaCl2溶液,均出现白色沉淀,此沉淀不溶于稀盐酸,经过滤、洗涤、干燥,称量得到的固体质量分别为Xg、Yg.计算SO2+Cl2?SO2Cl2反应中,SO2的转化率(用含X、Y的代数式表示).
19.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | T℃时,pH=6的纯水中,含有的OH-数目为1×10-6NA | |
| B. | 标准状况下,22.4LCCl4中含有的共用电子对数目为4.0NA | |
| C. | 50g98%的浓硫酸中,所含的氧原子数目为2NA | |
| D. | 1molNa2O2与足量CO2充分反应转移的电子数目为NA |
6.电解质是一类在水溶液里或熔融状态下能够导电的化合物.下列物质属于电解质的是( )
| A. | Cu | B. | K2SO4 | C. | SO2 | D. | NaOH溶液 |
16.下列各组离子在水溶液中能大量共存的是( )
| A. | Cu2+、H+、SO42-、Cl- | B. | Na+、Ba2+、NO3-、CO32- | ||
| C. | Al3+、H+、CO32-、Cl- | D. | Ba2+、OH-、Fe2+、NO3- |
3.下列说法正确的是( )
| A. | 实验室中可用燃烧法处理CO、H2、H2S等可燃性尾气 | |
| B. | 检验硫酸亚铁铵晶体中是否含有结晶水:取一试管,用药匙加入2克硫酸亚铁铵晶体,并在试管口塞上一团蘸有少量无水硫酸铜粉末的棉花,同时塞紧塞子,点燃酒精灯加热试管,观察现象 | |
| C. | 取一药匙铁粉、半药匙食盐置于一片塑料薄膜上,混合均匀,滴一滴管水,包起塑料薄膜(不包紧,有空气),用手摸立刻有发烫感 | |
| D. | 在中和滴定实验中,既可用标准溶液滴定待测液,也可用待测液滴定标准溶液 |
20.在密闭容器中发生如下反应:mA(g)+nB(g)→pC(g),达到平衡后,保持温度不变,将气体体积压缩到原来的$\frac{1}{3}$,当达到新平衡时,C的浓度变为原来2倍,下列说法错误的是( )
| A. | m+n<p | B. | 平衡向逆反应方向移动 | ||
| C. | A的转化率降低 | D. | C的体积分数增大 |
1.在烧瓶中充满干燥标准状况下HCl与N2的混合气,已知其相对分子质量为34.8,进行喷泉实验后所得溶液的物质的量浓度为( )
| A. | 0.022mol•L-1 | B. | 0.045 mol•L-1 | C. | 0.8 mol•L-1 | D. | 0.1 mol•L-1 |