题目内容
【题目】A一J是中学化学中常见的物质,其相互转化关系如下图所示,反应条件均已略去。A、B常温下均为无色液体,且均由两种相同的元素组成;C、F、G均为非金属单质,常温下C、F为无色气体,G可用于制取“84”消毒液;D是应用最广泛的金属;J溶液中滴入KSCN 溶液显红色。
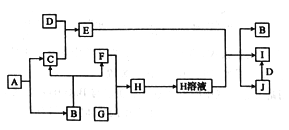
回答下列问题:
(1)A的化学式是_________,E 的俗称是_______。
(2)在空气中点燃F,然后把导管缓缓伸入盛满G的集气瓶中,观察到的实验现象是______。
(3)B和G能发生反应,写出反应的离子方程式______。
(4)G和I能发生反应,写出反应的化学方程式,并标出电子转移的方向和数目:______。
【答案】 H2O2 磁性氧化铁 氢气能在氯气中安静地燃烧,发出苍白色火焰,集气瓶口上方有白雾生成 Cl2+H2O=H++Cl-+HClO 
【解析】A、B常温下均为无色液体,且均由两种相同的元素组成,A生成B和C,C为气体,一般为H2O2生成H2O的反应,则A为H2O2,B为H2O,C为O2,G可用于制取“84”消毒液,G为Cl2,D是应用最广泛的金属,D为Fe,由转化关系可知F为H2,H为HCl,E为Fe3O4,J为FeCl3,I为FeCl2。
(1)由以上分析可知A为H2O2,E为Fe3O4,E的俗称为磁性氧化铁,故答案为:H2O2;磁性氧化铁;
(2)氢气在氯气中燃烧的实验现象为:氢气能在氯气中安静地燃烧,发出苍白色火焰,集气瓶口上方有白雾生成,故答案为:氢气能在氯气中安静地燃烧,发出苍白色火焰,集气瓶口上方有白雾生成;
(3) 氯气和水反应生成盐酸和次氯酸,次氯酸是弱酸,反应的离子方程式为Cl2+H2O=H++Cl-+HClO,故答案为:Cl2+H2O=H++Cl-+HClO;
(4)氯气和氯化亚铁发生氧化还原反应,反应的化学方程式为2FeCl2 + Cl2 = 2FeCl3,电子转移的方向和数目可以表示为![]() 或
或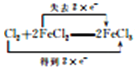 ,故答案为:
,故答案为:![]() 或
或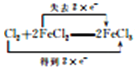 。
。

【题目】信息:已知在由Na2S、Na2SO3、Na2SO4三种物质组成的混合物中,钠元素的质量分数为46%,则氧元素的质量分数的计算方法为: Na2S、Na2SO3、Na2SO4有共同的部分Na2S,可拆变合一为(Na2S)Ox,则硫元素的质量分数为
2Na﹣﹣﹣ | S |
46% | 32% |
则氧元素的质量分数为1﹣46%﹣32%=22%
由NaHS、MgSO4、NaHSO3组成的混合物中,硫元素的质量分数为32%,计算该混合物中氧元素的质量分数为 .

