题目内容
【题目】标准状况下,①6.72L NH3②1.204×1023个 H2S ③5.6g CH4④0.5mol HCl,下列关系正确的是( )
A.体积大小:④>③>①>②
B.原子数目:③>①>④>②
C.密度大小:④>②>③>①
D.质量大小:④>③>②>①
【答案】B
【解析】解:标准状况下,①6.72L NH3的物质的量为 ![]() =0.3mol; ②1.204×1023个 H2S的物质的量为
=0.3mol; ②1.204×1023个 H2S的物质的量为 ![]() =0.2mol;③5.6g CH4 的物质的量为
=0.2mol;③5.6g CH4 的物质的量为 ![]() =0.4mol;④0.5mol HCl,A、由上述计算可知物质的量④>③>①>②,相同条件下,体积之比等于物质的量之比,所以体积大小④>③>①>②,故A正确;B、①标准状况6.72L NH3中原子的物质的量为0.3mol×4=1.2mol,②1.204×1023个 H2S含有的原子的物质的量为0.2mol×3=0.6mol; ③5.6g CH4含有的原子的物质的量为0.4mol×5=2mol;④0.5mol HCl含有的原子的物质的量为0.5mol×2=1mol,原子数目之比等于物质的量之比,所以原子数目③>①>④>②,故B正确;C、同温同压下,密度之比等于相对分子质量之比,①NH3相对分子质量为17;②H2S 相对分子质量为34; ③CH4相对分子质量为16④HCl相对分子质量为36.5,故密度大小④>②>①>③,故C错误;D、①NH3质量为17g/mol×0.3mol=5.1g;②H2S 质量为34g/mol×0.2mol=6.8g; ③CH4量为16g/mol×0.4mol=6.4g;④HCl质量为36.5g/mol×0.5mol=18.25g,故质量大小④>②>③>①,个D错误.故选:B.
=0.4mol;④0.5mol HCl,A、由上述计算可知物质的量④>③>①>②,相同条件下,体积之比等于物质的量之比,所以体积大小④>③>①>②,故A正确;B、①标准状况6.72L NH3中原子的物质的量为0.3mol×4=1.2mol,②1.204×1023个 H2S含有的原子的物质的量为0.2mol×3=0.6mol; ③5.6g CH4含有的原子的物质的量为0.4mol×5=2mol;④0.5mol HCl含有的原子的物质的量为0.5mol×2=1mol,原子数目之比等于物质的量之比,所以原子数目③>①>④>②,故B正确;C、同温同压下,密度之比等于相对分子质量之比,①NH3相对分子质量为17;②H2S 相对分子质量为34; ③CH4相对分子质量为16④HCl相对分子质量为36.5,故密度大小④>②>①>③,故C错误;D、①NH3质量为17g/mol×0.3mol=5.1g;②H2S 质量为34g/mol×0.2mol=6.8g; ③CH4量为16g/mol×0.4mol=6.4g;④HCl质量为36.5g/mol×0.5mol=18.25g,故质量大小④>②>③>①,个D错误.故选:B.
A、相同条件下,体积之比等于物质的量之比;
B、计算各物质中原子的物质的量,微原子数目之比等于物质的量之比;
C、同温同压下,密度之比等于相对分子质量之比;
D、计算各物质的物质的量,再根据m=nM计算质量,据此进行判断.

【题目】草酸与高锰酸钾在酸性条件下能够发生如下反应:MnO4-+H2C2O4+H+-Mn2++CO2↑+H2O(未配平)
Ⅰ.甲同学研究外界因素对反应速率影响,设计如下实验方案:
用4mL0.001mol/LKMnO4溶液与2mL0.01mol/LH2C2O4溶液,研究不同条件对化学反应速率的影响.改变的条件如下:
组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
A | 2mL | 20 | |
B | 2mL | 20 | 10滴饱和MnSO4溶液 |
C | 2mL | 30 | |
D | 1mL | 20 | V1mL蒸馏水 |
E | 0.5mL | 20 | V2mL蒸馏水 |
(1)完成上述实验方案设计,其中:V1= ______ ,V2= ______ ;
(2)如果研究温度对化学反应速率的影响,使用实验 ______ 和 ______ .
(3)甲同学在做A组实验时,发现反应开始时速率较慢,随后加快.他分析认为高锰酸钾与 草酸溶液的反应放热,导致溶液温度升高,反应速率加快;从影响化学反应速率的因素看,你猜想还可能是 ______ ;
Ⅱ.乙同学利用如图测定反应速率
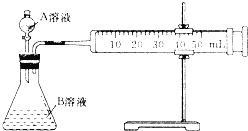
回答下列问题
(4)实验时要检查装置的气密性,简述操作的方法是 ______ ;
(5)乙同学通过生成相同体积的CO2来表示反应的速率,需要 ______ 仪来记录数据.
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
A. A B. B C. C D. D