题目内容
【题目】 (1)在标准状况下,8.96L的甲烷和一氧化碳的混合气体的质量为7.6g,混合气体平均摩尔质量为_____g/mol,混合气体中的甲烷的体积为_____L,一氧化碳的质量为_____g。
(2)某二价金属的氯化物(MCl2)23.75g中含3.01×1个Cl-,则MCl2的物质的量是_____mol,M的相对原子质量为_____。
(3)三种正盐的混合溶液中含有0.2mol NO3-、0.45mol Mg2+、0.4mol Cl-、SO42-,则n(SO42-)为_____mol。
【答案】19g/mol 6.72L 2.8g 0.25 24 0.15mol
【解析】
(1)甲烷和一氧化碳的质量为7.6g,体积为8.96L,在标况下是0.4mol,所以混合气体平均摩尔质量为7.6g÷0.4mol=19g/mol,甲烷的摩尔质量为16 g/mol,一氧化碳的摩尔质量是28 g/mol,根据十字交叉法: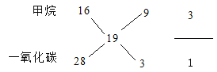 ,甲烷占了3/4,物质的量为0.3mol,体积为6.72L,一氧化碳占了1/4,物质的量为0.1mol,质量为2.8g。故答案为:19,6.72,2.8。
,甲烷占了3/4,物质的量为0.3mol,体积为6.72L,一氧化碳占了1/4,物质的量为0.1mol,质量为2.8g。故答案为:19,6.72,2.8。
(2)3.01×1023个Cl-的物质的量是0.5mol,则MCl2的物质的量是0.25mol,MCl2的摩尔质量是23.75g÷0.25mol=95g/mol,故M的相对原子质量为95-2×35.5=24。故答案为:0.25,24。
(3)根据电荷守恒,n(NO3-)+2n(SO42-)+n(Cl-)+ n(OH-)= 2n(Mg2+)+n(H+),氢离子和氢氧根浓度很小,可以忽略,故n(SO42-)=0.15 mol。

练习册系列答案
相关题目