题目内容
【题目】(1)以Zn和Cu为电极,稀H2SO4为电解质溶液形成原电池。
①H2SO4所含化学键为____________;
②若有0.4mole-流过导线,则理论上负极质量减少____________g;
③若将稀硫酸换成硫酸铜溶液,电极质量增加的是____________(填“锌极”或“铜极”),原因是____________(用电极方程式表示);
(2)①T1温度时,在容积为2L的恒容密闭容器中发生反应:2NO(g)+O2(g)![]() 2NO2(g)。容器中各反应物和生成物的物质的量随时间变化如图所示。下列能判断达到化学平衡的是____________
2NO2(g)。容器中各反应物和生成物的物质的量随时间变化如图所示。下列能判断达到化学平衡的是____________
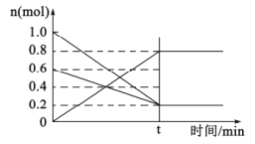
A.反应中NO与O2的物质的量之比为2:1
B.混合气体的总质量不随时间的变化而变化
C.单位时间内每消耗2nmolNO2,同时生成nmolO2
D.2v正(O2)=v逆(NO)
E.混合气体的压强不变
②0~t时间段,反应速率v(NO2)=____________。
【答案】共价键 13 铜极 Cu2++2e-=Cu DE ![]() mol/(L·min)
mol/(L·min)
【解析】
H2SO4是由非金属元素形成的共价化合物,Zn、Cu、稀H2SO4形成原电池时,Zn作负极,Zn失电子生成Zn2+,若将稀硫酸换成硫酸铜溶液,则正极为Cu2+得电子生成Cu,附着在正极表面,使其质量增加。T1温度时,在容积为2L的恒容密闭容器中发生反应:2NO(g)+O2(g)![]() 2NO2(g),利用图中曲线上物质的量的变化量,借助化学方程式,可确定三条曲线对应的物质,从而确定起始投入量:NO为1mol,O2为0.6mol,NO2为0mol;分析平衡状态时,利用“变量不变是平衡态”进行分析;在进行v(NO2)计算时,可从图中采集数据,然后进行计算。
2NO2(g),利用图中曲线上物质的量的变化量,借助化学方程式,可确定三条曲线对应的物质,从而确定起始投入量:NO为1mol,O2为0.6mol,NO2为0mol;分析平衡状态时,利用“变量不变是平衡态”进行分析;在进行v(NO2)计算时,可从图中采集数据,然后进行计算。
(1)以Zn和Cu为电极,稀H2SO4为电解质溶液形成原电池。
①H2SO4的结构式为 ,分子中不含有金属元素,所含化学键为共价键;
,分子中不含有金属元素,所含化学键为共价键;
②负极电极反应式为Zn-2e- ==Zn2+,若有0.4mole-流过导线,则理论上负极质量减少![]() =13g;
=13g;
③若将稀硫酸换成硫酸铜溶液,则在正极,Cu2+得电子生成Cu,附着在正极的表面,所以电极质量增加的是铜极,原因是Cu2++2e-=Cu;答案为:共价键;13;铜极;Cu2++2e-=Cu;
(2)①参照化学方程式,从图中可采集以下信息:起始投入量:NO为1mol,O2为0.6mol,NO2为0mol。
A.反应过程中NO与O2的物质的量之比始终为2:1,所以二者比值为2:1时,不一定达平衡状态,A不符合题意;
B.反应混合物都为气体,在反应过程中,混合气体的总质量始终不随时间的变化而变化,总质量不变时,反应不一定达平衡状态,B不符合题意;
C.单位时间内每消耗2nmolNO2,同时生成nmolO2,反应进行的方向相同,不一定达平衡状态,C不符合题意;
D.2v正(O2)=v逆(NO),反应进行的方向相反,且速率之比等于化学计量数之比,反应达平衡状态,D符合题意;
E.因为反应前后气体的分子数不等,所以只有在平衡状态时,混合气体的压强不变,E符合题意;
故选DE;
②0~t时间段,生成NO2的物质的量为0.8mol,反应速率v(NO2)= =
=![]() mol/(L·min)。答案为:DE;
mol/(L·min)。答案为:DE;![]() mol/(L·min)。
mol/(L·min)。

【题目】下表为元素周期表的一部分,表中列出12种元素在周期表中的位置,按要求回答下列问题。
周期\族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ⑥ | (11) | ⑧ | ⑩ | ||||
三 | ① | ③ | ⑤ | ⑦ | (12) | ⑨ | ||
四 | ② | ④ |
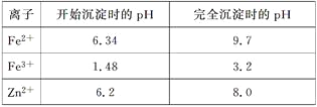
(1)在这12种元素中,化学性质最不活泼的元素名称是______,得电子能力最强的原子是_____(用元素符号表示);元素⑦的最高价氧化物对应的水化物是_____(写化学式)。
(2)
(3)①⑧⑨三种元素单核离子半径由大到小的顺序是(用相应的离子符号表示) ______。
(4)请写出:
(ⅰ) ③的单质置换出⑥的单质的化学方程式:_________________________。
(ⅱ) ⑤和(11)两种元素最高价氧化物对应的水化物相互反应的离子方程式为___________。
(ⅲ)元素⑨的单质和元素①的最高价氧化物对应的水化物常温下反应的化学方程式为__。
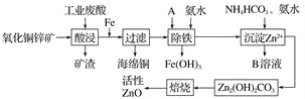
【题目】纳米TiO2具有十分宝贵的光学性质,在汽车工业及诸多领域都显示出美好的发展前景。下图是以硫酸氧钛为原料制备纳米二氧化钛的工艺流程图:

回答下列问题:
(1)反应I中发生两个反应,其一是尿素[CO(NH2)2]与H2O反应生成CO2和NH3·H2O,则另一反应的离子方程式为____。
(2)判断TiO(OH)2沉淀是否洗净的实验操作和现象是:____。
(3)为了减少制备过程中的“三废”排放,将上述流程中的“滤液”经过____、____、_____(填基本操作)即可回收________(填化学式)。
(4)为研究反应温度、反应时间、反应物物质的量配比等因素对制备纳米二氧化钛产率的影响。设计如下实验:
实验编号 | 反应温度/℃ | 反应时间/h | 反应物物质的量配比 |
① | 90 | 1 | 2:1 |
② | 90 | 2 | 3:1 |
③ | 90 | 1 | |
④ | 100 | 2 | 3:1 |
实验②和④的实验目的是___,实验③中反应物物质的量配比为___。反应I中TiO2+浓度对TiO2的产率和粒径的影响如图:

结合图中信息,你认为为达到工艺目的,最合适的TiO2+浓度为_______。