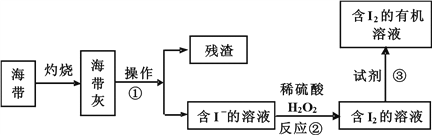
题目内容
【题目】太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质。
(1)基态铜原子的电子排布式为_____________;已知高温下CuO![]() Cu2O+O2,从铜原子价层电子结构(3d和4s轨道上应填充的电子数)变化角度来看,能生成Cu2O的原因是___________________________。
Cu2O+O2,从铜原子价层电子结构(3d和4s轨道上应填充的电子数)变化角度来看,能生成Cu2O的原因是___________________________。
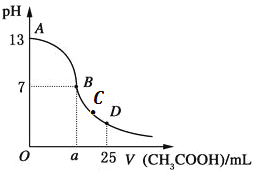
(2)硒、硅均能与氢元素形成气态氢化物,则它们形成的最简单的氢化物中,分子构型分别为____________, 若“Si-H”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为Se____Si (填“>”、“<”)。人们把硅与氢元素形成的一类化合物叫硅烷。硅烷的组成、结构与相应的烷烃相似,硅烷的沸点与相对分子质量的关系如图所示,呈现这种变化的原因是_____________________________________________。

(3)与铟、镓元素处于同一主族的硼元素具有缺电子性(价电子数少于价层轨道数),其化合物可与具有孤电子对的分子或离子生成配合物,如BF3能与NH3反应生成BF3·NH3。BF3·NH3中B原子的杂化轨道类型为______, B与N之间形成___________键。
(4)金刚砂(SiC)的硬度为9.5,其晶胞结构如下图所示,则金刚砂晶体类型为_________________,在SiC中,每个C原子周围最近的C原子数目为___个;若晶胞的边长为a pm,则金刚砂的密度为____g/cm3 (用NA表示阿伏伽德罗常数的值)。

【答案】 1s22s22p63s23p63d104s1或[Ar]3d104s1 CuO中铜的价层电子排布为3d9,Cu2O中铜的价层电子排布为3d10,后者处于稳定的全充满状态而前者不是,因而二价铜能在一定条件下转化为更稳定的一价铜 V形 正四面体形 > 硅烷为分子晶体,随相对分子质量增大,分子间作用力增强,熔沸点升高 sp3杂化 配位 原子晶体 12 1.6×1032/ (a3·NA)
【解析】分析:(1)原子核外电子排布决定着元素的稳定性,特别是全满、半满和全空比较稳定,因此通过铜原子的核外电子排布可解答;(2)根据已知物质H2O和CH4的分子结构可推知H2Se和SiH4的分子结构,电负性简单理解就是原子吸引电子的能力,结构相似的物质,其熔沸点可通过分子间作用力大小去判断;(3)BF3与NH3以配位键结合成化合物BF3·NH3时,B元素要形成四个键,所以只能以sp3杂化;(4)根据金刚石的晶体结构可推测SiC的晶体结构,通过晶胞中含有的原子数和晶胞的边长,可计算出晶胞的密度。
详解:(1)已知铜的原子序数为29,其原子核外电子排布为1s22s22p63s23p63d104s1或[Ar]3d104s1;CuO中铜是+2价,价电子排布为3d9,而Cu2O中铜是+1价,价电子排布为3d10,后者处于稳定的全充满状态而前者不是,因此CuO能在一定条件下转化为更稳定的Cu2O。
(2)由于O与Se同族,C与Si同族,它们形成的最简单的氢化物中,H2O分子是V型结构,则H2Se也是V型结构,CH4是正四面体结构,可知SiH4也是正四面体结构;在Si-H中共用电子对偏向氢元素,即氢的电负性>硅,氢气与硒反应时单质硒是氧化剂,则硒吸引电子能力>氢,所以电负性 Se>Si;由图象可知,在一系列硅烷中,随相对分子质量的增大,分子间作用力增强,所以熔沸点升高。
(3)B元素最外层只有3个电子,但有4个轨道,所以可与具有孤电子对的分子或离子以配位键形成配合物,因此在配合物BF3·NH3中B原子的杂化轨道类型为sp3杂化,在B和N之间形成配位键。
(4) 金刚砂晶体是由C原子和Si原子形成的原子晶体,在该晶胞中含有的C=4,Si= ![]() =4,即含有4个SiC,该晶胞为面心立方,且C和Si可以互换,每两个C原子间最近的距离为面对角线的一半,所以每个C周围距离最近的C原子有
=4,即含有4个SiC,该晶胞为面心立方,且C和Si可以互换,每两个C原子间最近的距离为面对角线的一半,所以每个C周围距离最近的C原子有![]() =12个,已知晶胞的边长为a pm,即a×10-10cm,其体积为a3×10-30cm3,质量为
=12个,已知晶胞的边长为a pm,即a×10-10cm,其体积为a3×10-30cm3,质量为![]() g,则金刚砂的密度为
g,则金刚砂的密度为![]() g/cm3。
g/cm3。

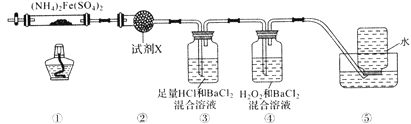
【题目】工业上用苯和1,2—二氯乙烷制联苄的反应原理如下
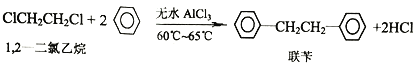
实验室制取联苄的装置如图所示(加热和夹持仪器略去)
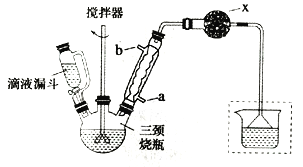
实验步骤:
①在三颈烧瓶中加入120.0mL苯和适量无水AlCl3,由滴液漏斗滴加10.0mL 1,2-二氯乙烷,控制反应温度在60~65℃,反应约60min。
②将反应后的混合物依次用2%Na2CO3溶液和水洗涤,在所得产物中加入少量无水MgSO4固体,静置、过滤,蒸馏收集一定温度下的馏分,得联苄18.2g。
相关物理常数和物理性质如下表:
名称 | 相对分子质量 | 密度/g·cm-3 | 熔点/℃ | 沸点/℃ | 溶解性 |
苯 | 78 | 0.88 | 5.5 | 80.1 | 难溶于水,易溶于乙醇 |
1,2-二氯乙烷 | 99 | 1.27 | -35.3 | 83.5 | 难溶于水,可溶于苯 |
联苄 | 182 | 0.98 | 52 | 284 | 难溶于水,易溶于苯 |
(1)和普通分液漏斗相比,使用滴液漏斗的优点是_______________________;球形冷凝管进水口是____________(选填“a”或“b”)
(2)仪器X的名称是________________;装置中虚线部分的作用是____________。
(3)洗涤操作中,用2%Na2CO3溶液洗涤的目的是___________;水洗的目的是____________。
(4)在进行蒸馏操作时,应收集____________℃的馏分。
(5)该实验中,联苄的产率约为____________%(小数点后保留两位)。