题目内容
【题目】海水是宝贵的资源宝库,目前氯碱工业、海水提镁、海水提溴为人类提供了大量工业原料。下图是海水综合利用的部分流程图,据图回答问题:

(1)由海水晒制的粗盐中含有Ca2+、Mg2+、SO42-等离子,为除去这些离子,所加试剂及其先后顺序为(写化学式) ______________________。
(2)①电解饱和食盐水的化学反应方程式为______________。
②制取MgCl2的过程中涉及反应:MgCl2·6H2O![]() MgCl2+6H2O,该反应要在HCl气氛中进行,原因是_______________。
MgCl2+6H2O,该反应要在HCl气氛中进行,原因是_______________。
(3)苦卤中通入Cl2置换出Br2,吹出后用SO2吸收,写出用SO2吸收发生的离子方程式_________,由此判断Cl2、Br2、SO2的氧化性由强到弱的顺序为__________________。
(4)也有工艺是在吹出Br2后用碳酸钠溶液吸收,形成溴化钠和溴酸钠,同时有CO2放出。该反应的离子方程式是_____________;最后再用H2SO4处理得到Br2,之后加入CCl4进行Br2的萃取,最终用_____________方法得到单质Br2。
【答案】BaCl2、NaOH、Na2CO3、HCl 2NaCl+2H2O![]() Cl2↑+H2↑+2NaOH 防止MgCl2水解 Br2+SO2+2H2O=2Br-+4H++SO42- Cl2>Br2>SO2 3Br2+3CO32-═5Br-+BrO-3+3CO2↑ 蒸馏
Cl2↑+H2↑+2NaOH 防止MgCl2水解 Br2+SO2+2H2O=2Br-+4H++SO42- Cl2>Br2>SO2 3Br2+3CO32-═5Br-+BrO-3+3CO2↑ 蒸馏
【解析】
(1)除去Ca2+用Na2CO3、除去Mg2+用NaOH、除去SO42-用BaCl2;为了使杂质完全除去,所加除杂试剂必须过量,过量的除杂试剂成为新杂质,所以Na2CO3还用于除去过量的BaCl2,Na2CO3溶液必须在BaCl2溶液之后加入;过滤后加入稀盐酸除去过量的NaOH和Na2CO3。
(2)①电解饱和食盐水生成NaOH、H2和Cl2。
②MgCl2发生水解生成Mg(OH)2和HCl,HCl可防止MgCl2水解。
(3)苦卤中通入Cl2置换出Br2,吹出后用SO2吸收,涉及的反应有Cl2+2Br-=2Cl-+Br2、Br2+SO2+2H2O=H2SO4+2HBr;根据“同一氧化还原反应中,氧化性:氧化剂>氧化产物”比较氧化性强弱。
(4)Br2与Na2CO3溶液反应的化学方程式为3Br2+3Na2CO3=5NaBr+NaBrO3+3CO2↑。加入CCl4萃取得到Br2的四氯化碳溶液,要获得单质Br2应用蒸馏法。
(1)除去Ca2+用Na2CO3、除去Mg2+用NaOH、除去SO42-用BaCl2;为了使杂质完全除去,所加除杂试剂必须过量,过量的除杂试剂成为新杂质,所以Na2CO3还用于除去过量的BaCl2,Na2CO3溶液必须在BaCl2溶液之后加入;过滤后加入稀盐酸除去过量的NaOH和Na2CO3;所加试剂及先后顺序为BaCl2、NaOH、Na2CO3、HCl(或NaOH、BaCl2、Na2CO3、HCl)。
(2)①电解饱和食盐水生成NaOH、H2和Cl2,反应的化学方程式为2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑。
2NaOH+H2↑+Cl2↑。
②若直接加热MgCl2·6H2O,MgCl2会发生水解:MgCl2+2H2O![]() Mg(OH)2+2HCl,加热时由于HCl的挥发使水解平衡正向移动,最终不能制得无水MgCl2;在HCl气氛中进行HCl会带走结晶水,防止MgCl2的水解,从而制得无水MgCl2。
Mg(OH)2+2HCl,加热时由于HCl的挥发使水解平衡正向移动,最终不能制得无水MgCl2;在HCl气氛中进行HCl会带走结晶水,防止MgCl2的水解,从而制得无水MgCl2。
(3)苦卤中通入Cl2置换出Br2,吹出后用SO2吸收,涉及的反应有Cl2+2Br-=2Cl-+Br2、Br2+SO2+2H2O=H2SO4+2HBr,用SO2吸收Br2的离子方程式为Br2+SO2+2H2O=4H++SO42-+2Br-。反应“Cl2+2Br-=2Cl-+Br2”中氧化剂为Cl2,氧化产物为Br2,同一氧化还原反应中,氧化性:氧化剂>氧化产物,则氧化性:Cl2>Br2;反应“Br2+SO2+2H2O=H2SO4+2HBr”中氧化剂为Br2,SO2为还原剂,氧化性:Br2>SO2;则Cl2、Br2、SO2的氧化性由强到弱的顺序为Cl2> Br2>SO2。
(4)吹出Br2后用碳酸钠溶液吸收,形成溴化钠和溴酸钠,同时有CO2放出,Br2与Na2CO3溶液反应的化学方程式为3Br2+3Na2CO3=5NaBr+NaBrO3+3CO

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案【题目】含氮化合物在材料方面的应用越来越广泛。
(1)甲胺(CH3NH2)是合成太阳能敏化剂的原料。工业合成甲胺原理:
CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g)△H。
CH3NH2(g)+H2O(g)△H。
①已知键能指断开1mol气态键所吸收的能量或形成1mol气态键所释放的能量。几种化学键的键能如下表所示:
化学键 | C-H | C-O | H-O | N-H | C-N |
键能/kJ·mol-1 | 413 | 351 | 463 | 393 | 293 |
则该合成反应的△H=______________。
②一定条件下,在体积相同的甲、乙、丙、丁四个容器中,起始投入物质如下:
NH3(g)/mol | CH3OH(g)/mol | 反应条件 | |
甲 | 1 | 1 | 498K,恒容 |
乙 | 1 | 1 | 598K,恒容 |
丙 | 1 | 1 | 598K,恒压 |
丁 | 2 | 3 | 598K,恒容 |
达到平衡时,甲、乙、丙、丁容器中的CH3OH转化率由大到小的顺序为_______________。
(2)工业上利用镓(Ga)与NH3在高温下合成固体半导体材料氮化镓(GaN),其反应原理为2Ga(s)+2NH3(g)![]() 2GaN(s)+3H2(g)△H=-30.81kJ·mol-1。
2GaN(s)+3H2(g)△H=-30.81kJ·mol-1。
①在密闭容器中充入一定量的Ga与NH3发生反应,实验测得反应体系与温度、压强的相关曲线如图所示。图中A点与C点的化学平衡常数分别为KA和KC,下列关系正确的是_________(填代号)。

a.纵轴a表示NH3的转化率 b.纵轴a表示NH3的体积分数 c.T1<T2 d.KA<Kc
②镓在元素周期表位于第四周期第ⅢA族,化学性质与铝相似。氮化镓性质稳定,不溶于水,但能缓慢溶解在热的NaOH溶液中,该反应的离子方程式为_____________________。
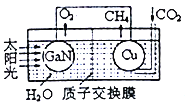
(3)用氮化镓与铜组成如图所示的人工光合系统,利用该装置成功地以CO2和H2O为原料合成CH4。铜电极表面发生的电极反应式为___________。两电极放出O2和CH4相同条件下的体积比为________,为提高该人工光合系统的工作效率,可向装置中加入少量的__________(填“盐酸”或“硫酸”)。