题目内容
【题目】砷(As)是第33号元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)砷在元素周期表中的位置是__________________________。
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式_________________________________________。该反应需要在加压下进行,原因是__________________________。
(3)已知:2As(s)+3H2(g)+4O2(g)=2H3AsO4(s)△H1
H2(g)+ ![]() O2(g)=H2 O(l) △H2
O2(g)=H2 O(l) △H2
2As(s)+ ![]() O2(g) =As2O5(s)△H3
O2(g) =As2O5(s)△H3
则反应 As2O5(s) +3H2O(1)= 2H3AsO4(s)的△H=____________。
(4)298K时,将20mL3xmol·L-1Na3AsO3、20 mL 3xmol·L-1I2和20mL NaOH溶液混合,发生反应:AsO33-(aq)+I2+2OH-![]() AsO43-+2I-+H2O。溶液中c(AsO43-) 与反应时间(t)的关系如图所示。
AsO43-+2I-+H2O。溶液中c(AsO43-) 与反应时间(t)的关系如图所示。
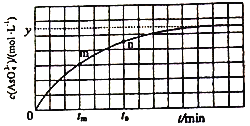
①下列不能判断反应达到平衡的是________(填标号)。
a.溶液的pH不再变化 b.v(I-)=2v(AsO33-)
c.c(AsO43-)/c(AsO33-)不再变化 d.c(I-)=ymol·L-1
②tm时v逆 ______tn时v逆(填“>”“<”或“=”),理由是_____________。
③若平衡时溶液的c(OH-)=lmol/L,则该反应的平衡常数K为____________。
【答案】 第四周期第VA族 2As2S3+5O2+6H2O=4H3AsO4+6S 增加反应物O2的浓度,提高As2S3的转化速率 △H1-3△H2-△H3 bd < tm时生成物浓度较低 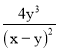 (mol·L-1)-1 (单位不写不扣分)
(mol·L-1)-1 (单位不写不扣分)
【解析】(1)砷元素原子序数为33,原子核外有四个电子层,最外层5个电子,在元素周期表中位于第四周期第VA族,故答案为:第四周期第VA族;
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫,砷元素化合价+3价变化为+5价,反应的化学方程式为2As2S3+5O2+6H2O=4H3AsO4+6S,增大压强,可增大反应物O2的浓度,反应速率加快,可以提高As2S3的转化速率,故答案为:2As2S3+5O2+6H2O=4H3AsO4+6S;增大压强,可增大反应物O2的浓度,提高As2S3的转化速率;
(3)已知:①2As(s)+3H2(g)+4O2(g)=2H3AsO4(s)△H1,②H2(g)+ ![]() O2(g)=H2O(l)△H2,③2As(s)+
O2(g)=H2O(l)△H2,③2As(s)+ ![]() O2(g)=As2O5(s)△H3,则利用盖斯定律将①-②×3-③可得As2O5(s)+3H2O(l)=2H3AsO4(s)△H=△H1-3△H2-△H3,故答案为:△H1-3△H2-△H3;
O2(g)=As2O5(s)△H3,则利用盖斯定律将①-②×3-③可得As2O5(s)+3H2O(l)=2H3AsO4(s)△H=△H1-3△H2-△H3,故答案为:△H1-3△H2-△H3;
(4)①a.溶液pH不变时,则c(OH-)也保持不变,反应达到平衡状态,故a正确;b.同一个化学反应,速率之比等于化学计量数之比,无论是否达到平衡,都存在v(I-)=2v(AsO33-),故b错误;c.c(AsO43-)/c(AsO33-)不再变化,可说明各物质的浓度不再变化,反应达到平衡状态,故c正确;d.由图可知,当c(AsO43-)=ymolL-1时,浓度不再发生变化,则达到平衡状态,由方程式可知此时c(I-)=2ymolL-1,所以c(I-)=ymolL-1时没有达到平衡状态,故d错误;故答案为:bd;
②tm时比tn时AsO43-浓度更小,则逆反应速率更小,故答案为:小于;tm时AsO43-浓度更小,反应速率更慢;
③反应前,三种溶液混合后,Na3AsO3的浓度为3xmol/L×![]() =xmol/L,同理I2的浓度为xmol/L,反应达到平衡时,c(AsO43-)为ymol/L,则反应生成的c(I-)=2ymol/L,消耗的AsO33-、I2的浓度均为ymol/L,平衡时c(AsO33-)=(x-y)mol/L,c(I2)=(x-y)mol/L,溶液中c(OH-)=1mol/L,则K=
=xmol/L,同理I2的浓度为xmol/L,反应达到平衡时,c(AsO43-)为ymol/L,则反应生成的c(I-)=2ymol/L,消耗的AsO33-、I2的浓度均为ymol/L,平衡时c(AsO33-)=(x-y)mol/L,c(I2)=(x-y)mol/L,溶液中c(OH-)=1mol/L,则K=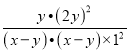 =
= ,故答案为:
,故答案为:  。
。

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案【题目】常温下,部分酸的电离平衡常数如下:
化学式 | HK | HCN | H2CO3 |
电离常数 | Ka=3.5×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7,Ka2=5.6×10-11 |
(1)c (H+)相同的三种酸,其酸的浓度从大到小为____________________。
(2)若HCN酸的起始浓度为0.0lmol/L,平衡时c(H+)约为____________mol/L。
若使此溶液中HCN的电离程度增大且c(H+)也增大的方法是____________。
(3)中和等量的NaOH,消耗等pH的氢氟酸和硫酸的体积分别为aL、bL,则a______b (填“大于”、“小于”或“等于”)。中和等浓度、等体积的氢氟酸和硫酸需要NaOH的物质的量为n1、n2,则n1_________n2 (填“大于”、“小于”或“等于”)
(4)向NaCN中通入少量的CO2,发生的离子方程式为_________________________。
(5)设计实验证明氢氟酸比盐酸的酸性弱___________________________________________________。
【题目】下列实验中,所采取的分离方法与对应原理都正确的是( )
选项 | 目的 | 分离方法 | 原理 |
A. | 分离溶于水中的碘 | 乙醇萃取 | 碘在乙醇中的溶解度较大 |
B. | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯和乙醇的密度不同 |
C. | 除去KNO3固体中混杂的NaCl | 重结晶 | NaCl在水中的溶解度很大 |
D. | 除去丁醇中的乙醚 | 蒸馏 | 丁醇与乙醚的沸点相差较大 |