��Ŀ����
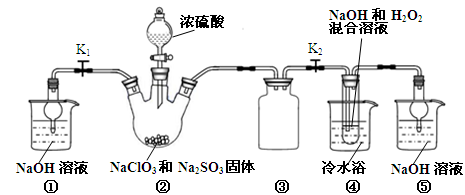
���ľ�������ظ�ԭ���۱��衱֮�����������⣬���и�������˾��ȵ��ο���Դ��Һ����Լؿ�Ϊ����������þ����ȶ��ֿ����ij�о���ѧϰС����ȡ�κ���±��Ũ��Һ������K+��Mg2+��Brһ��SO42һ��Clһ�ȣ�������ȡ�ϴ������Ȼ��ؾ��弰Һ�壨Br2��������������������̣�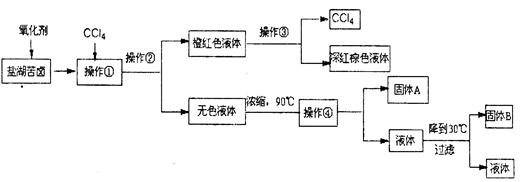
������������̣��ش�������⣺
��1�������ڵ��������Ҫ������ ��
��2��������ͼ�ܽ�����ߣ��õ��Ĺ���A����Ҫ�ɷ��� ���ѧʽ����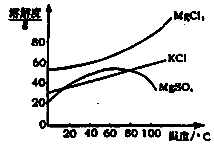
��3��ͬѧ�����һЩ�µķ����������������ں���ɫ��Һ���г����ᴿ���䷽�����£�
���й����ϡ�
| ��ѧʽ | BaCO3 | BaSO4 | Ca��OH��2 | MgCO3 | Mg��OH��2 |
| Ksp | 8.1��10һ9 | 1.08��10һ10 | 1.0��10һ4 | 3.5��10һ5 | 1.6��10һ11 |
����Ƴ��ӹ��̡�
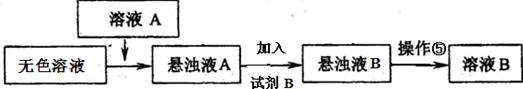
a����֪�Լ�B��K2CO3��Һ������ҺA����Ҫ�ɷ��� ���ѧʽ����
����ȡ�����Ȼ��ء�
b������ҺB���Ȳ����ϵμ�l mol�� L��1��������Һ��ͬʱ��pH��ֽ�����Һ��ֱ��pH=5ʱֹͣ�����ᣬ�õ���ҺC���ò�����Ŀ���� ������ҺC�����������У������������ò��������Ͻ��裬ֱ�����ֽ϶ྦྷ��ʱ��ֹͣ���ȡ�
���������ۡ�
c�����в������п�����ҺpH=12��ȷ��Mg2+�����������ṩ�����ݼ��㣬��ʱ��ҺB��Mg2+���ʵ���Ũ��Ϊ ��
��1����Һ©�� ��2��MgSO4
��3��a��Ba(OH)2 b����ȥδ��Ӧ��OH����CO32�� c��1.6��10��7mol/L
���������������1��������������Brһ��ΪBr2�������CCl4����ȡ��������Һ�е�Br2��ȡ������������٢ڷֱ�����ȡ����Һ��������Ҫ�����Ƿ�Һ©�����ձ�����2�������ֱܷۢ������������ȹ��ˣ������ܽ�����ߣ�ֻ��MgSO4���ܽ�����¶����߶���С����˹���A��MgSO4����MgCl2��KCl���嶼��Ҫ����Ũ������ȴ�ᾧ���ܵõ�����3����ҺA��Ŀ���dz�ȥ��Һ��Mg2+��SO42һ������KspԽС������Խ�ȳ�����ȫ�����Ӧѡ��OH����Ba2+�����ʣ�����Ҫ���������Ba(OH)2��Һ���������K2CO3��Һ��Ŀ���dz�ȥBa2+����������OH����CO32һ����Ҫ���������ȥ��pH=12����c(H+)=10��12mol/L��c(OH��)=Kw/c(H+)=10��2mol/L������Һ�д�������ƽ�⣺Mg(OH)2(s) Mg2++2OH������Ksp[Mg(OH)2]=c(Mg2+)��c2(OH��)�������й����ݼ���ɵã�c(Mg2+)=
Mg2++2OH������Ksp[Mg(OH)2]=c(Mg2+)��c2(OH��)�������й����ݼ���ɵã�c(Mg2+)=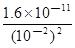 mol/L= 1.6��10��7mol/L��
mol/L= 1.6��10��7mol/L��
���㣺���������Ʊ����������⣬�漰���������ᴿ�IJ��������������������Լ���ѡ��Ŀ�Ľ��͡��ܶȻ���Ӧ�úͼ���ȿ��㡣

��ˮ�Ȼ���������������ϵ������ӡȾ��ýȾ����Ⱦ�ϻ�ԭ������������ұ��ҽҩ���������ҵ��һʵ��С��ģ�¹�ҵ������ȡ�Ȼ����������װ������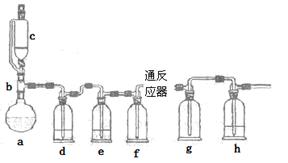
ͨ������������Ͽ�֪��
���ڳ�������500��ʱ�����봿��������Cl2��Ӧ������FeCl2�����¶Ƚϵ�ʱ������FeCl3��
��FeCl3�۷е�ͣ���������
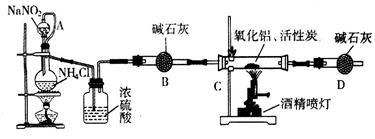
����������Ϣ�ش���ص�����
��1��abc������ϳ���ȡ������װ�ã���Ӧ������ȣ���д��a�������������Ļ�ѧ��Ӧ����ʽ ��
��2��d��eʢװ��ҩƷ�ֱ��� �� ��f��g�������� ��
��3����Ӧ��ΪӲ�ʲ����ܣ�����������������500�����ҷ�Ӧ��
�ٻ�ѧ��Ӧ����ʽΪ
��ʵ�����˳���ǣ���װ������ ��װ��ҩƷ�� �� ��ֹͣ���ȡ��ر�c�Ļ�����
��4��ʵ��С���¼��ʵ���������£�
| | �۲쵽�IJ������� |
| ��һ��ʵ�� | ��Ӧ�����а�������ɫ���塢gƿ�а����ͻ���ɫ���� |
| �ڶ���ʵ�� | ��Ӧ��������ɫ���壬gƿ�к���ɫ���̺ͻ���ɫ���� |
| ������ʵ�� | ��Ӧ��������ɫ���壬gƿ�л���ɫ���� |
�ٵ�һ��ʵ�飬����eƿû��ʢװ�κ�ҩƷ�����Եõ���ɫ���壬��ԭ���� ��
�ڵڶ���ʵ�飬gƿ�к���ɫ���̣���ԭ���� ��
��5��������ʵ��õ��Ĺ��壬����ܺ����������� �������Ҫ����Լ2��3mol/L��Ⱦ�ϻ�ԭ����Һ���������ȥ�������� ��
�ߴ��ȵ������ǵ��͵����ǽ������ϣ����Ʊ��뵼�����Ҫ���ϣ����ķ��ֺ�ʹ��������������һ�������������ߴ���ͨ�������·����Ʊ�����̼�ڸ����»�ԭ���������Ƶôֹ裨��Fe��Al��B��P�����ʣ����ֹ���������Ӧ�������Ȼ��裨��Ӧ�¶�Ϊ450��500�棩�����Ȼ��辭�ᴿ����������ԭ�ɵøߴ��衣������ʵ�����Ʊ����Ȼ����װ��ͼ��
�����Ϣ��a�����Ȼ�����ˮ����ˮ�⣻b���������������ڸ����¾���������ֱ�ӻ���������Ӧ���Ȼ��c���й����ʵ������������±���
| ���� | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| �е�/�� | 57.7 | 12.8 | �� | 315 | �� |
| �۵�/�� | ��70.0 | ��107.2 | �� | �� | �� |
| �����¶�/�� | �� | �� | 180 | 300 | 162 |
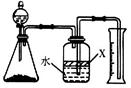
��ش��������⣺
��1������e������Ϊ ��װ��A��f�ܵ������� �����з�����Ӧ�����ӷ���ʽΪ ��
��2��װ��B�е��Լ��� ��
��3��ijѧϰС���������������ʵ�鷽���������ף�g��װ�â����ң�g��װ�â��Ǽ�������������������װ�þ��в���֮�����������ۺ���д�±���
| ���� | ����֮�� |
| �� | |
| �� | |
��4����������3�������ۻ����ϣ������һ������������ ��
��5��ͨ������������װ����ȡ���ռ����Ĵֲ����ͨ���������ƶ�����õ��ߴ������Ȼ��裬�����IJ������У�����Ԫ������ܻ����е�����Ԫ���� ����дԪ�ط��ţ���
����ʵ��װ�û������ȷ���� ( )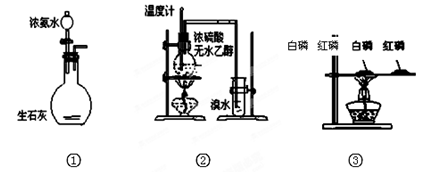
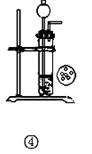
| A��ʵ��� ��ȡ���� |
| B��ʵ��� ��ˮ��ɫ֤������ϩ�������巢���ӳɷ�Ӧ |
| C��ʵ��� �ȽϺ��Ͱ����Ż�� |
| D��ʵ��� ��CaC2�ͱ���ʳ��ˮ��Ӧ��ȡC2H2 |
������ͼ��ʾװ�ý���ʵ�飬������Һ�����μ��뵽�������У��Թ��е��Լ�Ϊ�������±�����������۾���ȷ����
| ѡ�� | �� | �� | �� | �Թ������� | ���� |
| A | Ũ��ˮ | ��ʯ�� | AgNO3��Һ | ���������� | NH3��AgNO3��Һ����Ӧ |
| B | ���� | ̼���� | BaCl2��Һ | ����� | ��������ǿ��̼�� |
| C | ����ʳ��ˮ | ��ʯ | ����KMnO4��Һ | ��ɫ��ȥ | ��Ȳ�ɱ�KMnO4���� |
| D | Ũ���� | �������� | ��ˮ | ��ɫ��ȥ | SO2����Ư���� |
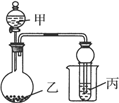
ij��ѧС��Ϊ�ⶨһ��������ijͭ���������ͭ���������������������ʵ�鷽����
�����й��ж��в���ȷ���� ����������
| A����ҺA����ҺB�������������NaOH��Һ |
| B������ҺBѡ��Ũ���ᣬ���ͭ����������ƫ�� |
| C������һ���ܲ�������������������ʣ��ͭ |
| D��ʵ�����з����������ʵʩ |
 ��
��