题目内容
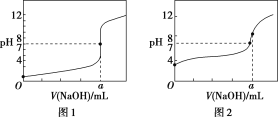
【题目】25 ℃时,将0.10mol/L的NaOH溶液逐滴滴入20 mL 0.10 mol/LCH3COOH溶液中,pH随滴入NaOH溶液体积的变化如下图所示。

(1)点①存在的电离平衡是___________。
(2)点②两溶液发生反应的离子方程式是_______。
(3)点③溶液的pH_____7(填“>”、“<”或“=”),此时c(Na+)_____c(CH3COO-)(填“>”、“<”或“=”)。
【答案】CH3COOH![]() CH3COO- + H+ CH3COOH+OH-=CH3COO-+H2O > >
CH3COO- + H+ CH3COOH+OH-=CH3COO-+H2O > >
【解析】
(1)点①是0.10mol/L CH3COOH溶液,CH3COOH是弱电解质,不完全电离,在溶液中醋酸分子电离产生醋酸根离子和氢离子,醋酸根离子和氢离子也会重新结合为醋酸分子,当达到电离平衡时,各种微粒的浓度不变,则点①存在的电离平衡是:CH3COOH![]() CH3COO- + H+;
CH3COO- + H+;
(2)点②为加入10mL 0.10mol/L的NaOH溶液,两溶液发生酸碱中和反应,则反应方程式为:CH3COOH+OH-=CH3COO-+H2O;
(3)点③为加入20mL 0.10mol/L的NaOH溶液,恰好生成CH3COONa,CH3COONa是强碱弱酸盐,在溶液中CH3COO-发生水解反应,消耗水电离产生的H+,当最终达到电离平衡时,溶液中c(OH-)>c(H+),使溶液呈碱性,则溶液pH>7,CH3COO-发生水解反应浓度减少,而Na+不水解,则溶液中c(Na+)>c(CH3COO-)。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目