题目内容
【题目】某实验小组以H2O2的分解为例,研究浓度、催化剂、溶液的酸碱性对反应速率的影响。在常温下按照如下方案设计实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2溶液 | 无 |
② | 10 mL 5% H2O2溶液 | 无 |
③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol/LFeCl3溶液 |
④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol/LFeCl3溶液 |
⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol/LFeCl3溶液 |
(1)实验①和②的目的是_________________________________。实验时由于没有观察到明显现象而无法得出结论。为了达到实验目的,你对原实验方案的改进措施是______________________________________________。
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图所示。
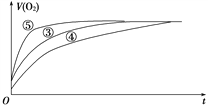
分析上图能够得出的实验结论是_________________________。
【答案】 探究浓度对反应速率的影响 向反应物中加入等量同种催化剂(或将盛有反应物的试管放入同一热水浴中) 碱性环境能增大H2O2的分解速率,酸性环境能减小H2O2的分解速率
【解析】(1)实验①、②中均没有使用催化剂,只是改变了H2O2的浓度,故实验①、②的目的是探究浓度对化学反应速率的影响。因实验过程中现象不明显,可采用升温或使用同种催化剂的方法加快反应速率来达到实验目的。(2)实验③、④、⑤中H2O2的浓度相同,并加入相同量的同种催化剂,而改变的条件是④中酸性增强,⑤中碱性增强。通过比较H2O2未完全分解前相同时间内产生O2的体积(⑤>③>④)可得出如下结论:溶液的碱性增强,能加快H2O2的分解,而溶液的酸性增强,能减慢H2O2的分解。

【题目】下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。 已知:2KMnO4+16HCl→2KCl+5Cl2↑+2MnCl2+8H2O
对实验现象的“解释或结论”正确的是
选项 | 实验现象 | 解释或结论 |
A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
C | d处立即褪色7 | 氯气与水生成了漂白性物质 |
D | e处变红色 | 还原性:Fe2+>Cl- |
A.A
B.B
C.C
D.D