题目内容
【题目】根据下图所示装置和操作,回答下列有关问题。 
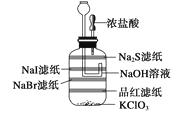
(1)按图Ⅰ所示装置,用两种不同的操作分别进行实验,观察B管中的现象。 ①操作1:先夹紧止水夹a,再使A管开始反应,实验中观察到B管中的现象是
。
②操作2:打开止水夹a,使A管反应一段时间后再夹紧止水夹a,实验中观察到B管
中的现象是。
③请说明造成两种操作现象不同的原因(如两种现象相同,此小题不用回答):
。
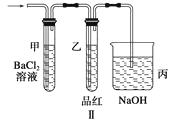
(2)上述装置实验结束后,取A管内反应所得的溶液,隔绝空气小心蒸干后,再高温煅 烧(有关装置和操作均已略去),最后留下红色固体,将分解时产生的气体按图Ⅱ所示装置依次通过洗气装置,结果试管甲内出现白色沉淀,试管乙内品红溶液红色褪去,回答:
① 用方程式表示试管甲产生白色沉淀的原因。
②根据实验现象写出A管内溶液蒸干后,在高温煅烧分解时所发生的化学反应方程式
。
③图Ⅱ中丙装置的作用是。
实验结束时,在装置丙中观察到的现象是。
【答案】
(1)液面升高且生成白色沉淀,且迅速变为灰绿色,最后变为红褐色;液面上升,有白色沉淀生成,且保持较长时间不变色;操作2中产生的H2将系统内空气赶尽,避免了Fe(OH)2的氧化
(2)O3+H2O+BaCl2===BaSO4↓+2HCl;2FeSO4 Fe2O3+SO3↑+SO2↑;吸收剩余的SO2气体;导管内倒吸一段液柱
【解析】由于Fe(OH)2极易被氧化为Fe(OH)3 , 溶液中溶解的O2就能把Fe(OH)2氧化。当夹紧a时,A试管便成了一个封闭体系,产生的H2使A试管内压强增大,将生成的FeSO4溶液压入B中,从而发生反应,有Fe(OH)2生成。而NaOH溶液中溶解的O2可将Fe(OH)2迅速氧化,最后转化成Fe(OH)3 , 所以,看到白色沉淀的时间很短。当进行操作2时,产生的H2首先通过导气管通入到B的NaOH溶液中,将其中溶解的O2赶走,再夹紧a时,FeSO4溶液压入B中,此时反应所产生的Fe(OH)2沉淀在一段时间内不变色;此题第二部分围绕FeSO4隔绝空气强热时的产物逆向推理,并利用已学过的氧化还原知识推断出FeSO4高温分解反应的化学方程式。

 中考解读考点精练系列答案
中考解读考点精练系列答案【题目】中和滴定是化学定量实验之一.某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,请填写下列空白: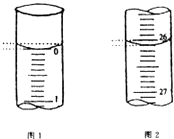
(1)在中和滴定的过程中有如下操作:①用标准溶液润洗滴定管 ②往滴定管内注入标准溶液 ③检查滴定管是否漏水 ④滴定 ⑤洗涤,则在操作过程中正确的顺序是 . (写序号)
(2)选用的指示剂是 . (a、石蕊 b、甲基橙)
(3)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视 .
(4)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是 .
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(5)若滴定开始和结束时,酸式滴定管中的液面如图所示,请将数据填入下面表格的空白处.
滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L 盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | |||
第二次 | 25.00 | 2.00 | 28.08 | 26.08 |
第三次 | 25.00 | 0.22 | 26.34 | 26.12 |
(6)请根据上表中数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)= .
(7)滴定终点的判定依据是 .
【题目】某实验小组以H2O2的分解为例,研究浓度、催化剂、溶液的酸碱性对反应速率的影响。在常温下按照如下方案设计实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2溶液 | 无 |
② | 10 mL 5% H2O2溶液 | 无 |
③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol/LFeCl3溶液 |
④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol/LFeCl3溶液 |
⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol/LFeCl3溶液 |
(1)实验①和②的目的是_________________________________。实验时由于没有观察到明显现象而无法得出结论。为了达到实验目的,你对原实验方案的改进措施是______________________________________________。
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图所示。
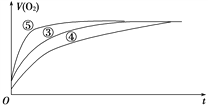
分析上图能够得出的实验结论是_________________________。