题目内容
(12分)决定物质性质的重要因素是物质结构。请回答下列问题。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
则,A的化合价 ▲ B的化合价(填“>”、“<”或“=”)。
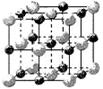
(2)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如右图所示),
其中3种离子晶体的晶格能数据如下表:
则该 4种离子晶体(不包括NaCl)熔点从高到低的顺序是: ▲ ,原因是: ▲ 。
(3)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 ▲ 。
(4)某配合物的分子结构如右图所示,
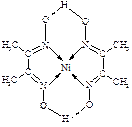
则N原子的杂化方式为 ▲ ;基态Ni原子的电子排布式 ▲ 。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
(2)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如右图所示),

其中3种离子晶体的晶格能数据如下表:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3401 |
(3)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 ▲ 。
(4)某配合物的分子结构如右图所示,
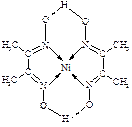
则N原子的杂化方式为 ▲ ;基态Ni原子的电子排布式 ▲ 。
(1)>(2)TiN>MgO>CaO>KCl (3)CrO2 (4)sp2 [Ar]3d84s2
略

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

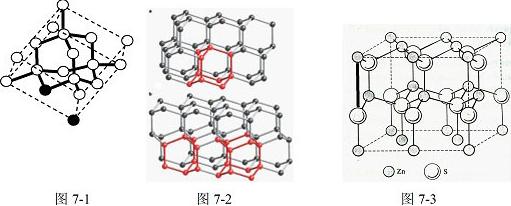
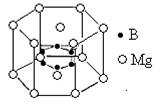
 周期表中前36号的元素,其原子序数依次增大。A与其他4种元素既不在同一周期又不在同一族。B和C属同一主族,D和E属同一周
周期表中前36号的元素,其原子序数依次增大。A与其他4种元素既不在同一周期又不在同一族。B和C属同一主族,D和E属同一周 期,又知E是周期表中1—18列中的第8列元素。D的原子序数比E小6,D跟B可形成
期,又知E是周期表中1—18列中的第8列元素。D的原子序数比E小6,D跟B可形成 离子化合物其晶胞结构如图。
离子化合物其晶胞结构如图。
 请回答:
请回答: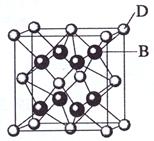
 ;
; 别该离子化合物是否为晶体,最可靠的科学方法是 ,该离子化合物晶体的密度为ag·cm-3,B、D两元素的相
别该离子化合物是否为晶体,最可靠的科学方法是 ,该离子化合物晶体的密度为ag·cm-3,B、D两元素的相 对原子质量分别为b、c,则晶胞的体积是 cm3(只要求列出算式)。
对原子质量分别为b、c,则晶胞的体积是 cm3(只要求列出算式)。