题目内容
(本小题满分9分) 如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定)。试回答下列问题:


(1)实验1甲针筒内的现象是:有___________生成,针筒活塞________移动(填向外、向内、不)。反应后甲针筒内有少量的残留气体,正确的处理方法是将其通入___________溶液中。
(2)实验2中,甲中的3mL气体是NO2和N2O4的混合气体,那么甲中最后剩余的无色气体是_______,写出NO2与H2O反应的化学方程式为____________________。
(3)实验3中,已知:3Cl2+2NH3===N2+6HCl。甲针筒处活塞有移动,针筒内有白烟产生外,气体的颜色变为____________。最后针筒内剩余气体的体积约为________mL。
(1)黄色固体;向内;NaOH。(每空1分)
(2)NO (1分); 3NO2+H2O=2HNO3+NO(2分)。
(3)无色(1分); 5(2分)
【解析】(1)SO2和H2S中硫元素的化合价分别是+4价和-2价,所以二者可以发生氧化还原反应生成单质硫和水,方程式为SO2+2H2S=3S+2H2O。所以反应后压强降低,针筒活塞向内移动。SO2和H2S均属于大气污染物,需要尾气处理,可用碱液来吸收。
(2)NO2溶于水的方程式为3NO2+H2O=2HNO3+NO,所以最终的气体是无色的NO。
(3)氯气可以将氨气氧化生成氮气,而氯气被还原生成氯化氢。根据方程式和有关反应物的体积可知,15ml氯气可以消耗10ml氨气,生成5ml氮气和30ml氯化氢。所以氨气剩余30ml,过量的氨气和氯化氢恰好反应生成氯化铵,从而出现白烟现象。因此最终的气体是5ml氮气。

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案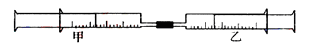

 2C(g)+xD(g),经5min达到平衡,此时生成2 mol C,测得D的平均反应速率为0.15 mol/(L·min),则平衡时A的物质的量浓度是____________;B的转化率是__________;x的值是___________。
2C(g)+xD(g),经5min达到平衡,此时生成2 mol C,测得D的平均反应速率为0.15 mol/(L·min),则平衡时A的物质的量浓度是____________;B的转化率是__________;x的值是___________。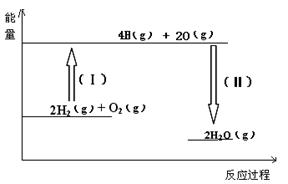
 2C(g)+xD(g),经5min达到平衡,此时生成2 mol C,测得D的平均反应速率为0.15 mol/(L·min),则平衡时A的物质的量浓度是____________;B的转化率是__________;x的值是___________。
2C(g)+xD(g),经5min达到平衡,此时生成2 mol C,测得D的平均反应速率为0.15 mol/(L·min),则平衡时A的物质的量浓度是____________;B的转化率是__________;x的值是___________。
