题目内容
已知某温度下0.1mol·L-1的NaHB(强电解质)溶液中c(H+)> c(OH-),则下列有关说法或关系式一定正确的是( )
①HB-的水解程度小于HB-的电离程度;
②c(Na+)=0.1mol·L-1> c(B2-);
③溶液的pH=1;
④c(Na+)= c(HB-)+2c(B2-)+ c(OH-)
①HB-的水解程度小于HB-的电离程度;
②c(Na+)=0.1mol·L-1> c(B2-);
③溶液的pH=1;
④c(Na+)= c(HB-)+2c(B2-)+ c(OH-)
| A.①② | B.②③ | C.②④ | D.①②③ |
A
试题分析:①某温度下0.1mol·L-1的NaHB (强电解质)溶液中c(H+)> c(OH-),则说明HB-电离作用大于水解作用。正确。②所以B2->H2B,NaHB=Na++HB-.HB-无论电离还是水解程度都是很微弱的,所以c(Na+)=0.1mol·L-1 = c(B2-)+c(HB-)+c(H2B)>c(B2-)。正确。③由于存在平衡HB-
 H++B2-,所以c(H+)<0.1mol/L,因此pH>1.错误。④ 根据物料守恒可得c(Na+)= c(B2-)+c(HB-)+c(H2B)。错误。因此关系式一定正确的是①②。选项为A。
H++B2-,所以c(H+)<0.1mol/L,因此pH>1.错误。④ 根据物料守恒可得c(Na+)= c(B2-)+c(HB-)+c(H2B)。错误。因此关系式一定正确的是①②。选项为A。
练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
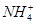 、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、
、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、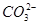 、
、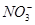 、
、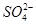 ,已知:
,已知: