��Ŀ����
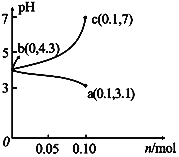
����Ŀ���Ҵ�������ϩ����ֱ��ˮ�Ϸ�����ˮ�Ϸ�������һЩת����ͼ��
ijЩ���ʵ��й��������±���
�۵�/�� | �е�/�� | ˮ���� | |
�Ҵ� | -114.1 | 78.3 | ���� |
��ȩ | -121 | 20.8 | ���� |
�������� | -83 | 77.0 | ���� |
�ش��������⣺
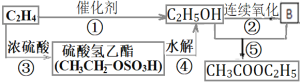
��1�����ˮ�Ϸ��е�ת���ۣ���ϩ��Ũ���ᷴӦ��������������(CH3CH2��OSO3H)���л���Ӧ������_____________��ת���ܵĻ�ѧ����ʽ��__________________��
��2��պ��B�IJ�����������������⻯�������ð���̣���Ӧ�Ļ�ѧ����ʽΪ________��ת���ݵĻ�ѧ����ʽΪ______________________________��
��3����һ����Ϊw��ͭ˿���ձ�ں�Ѹ�ٲ����Ҵ��У���ڵ�ͭ˿�ָ���ɫ��
��ʹͭ˿�ָ���ɫ�ķ�Ӧ�Ļ�ѧ����ʽΪ________________________��
����Ҫ֤��ͭ˿������ã�����Ҫ���еIJ�����_______________��
��4����֪��CH3CHO + NaHSO3 ��![]() ���������ǻ��һ����ƣ�������������ȩ�������·�ʽ�ᴿ��
���������ǻ��һ����ƣ�������������ȩ�������·�ʽ�ᴿ��
![]()
�٦����ǻ��һ����Ƶľ�������Ϊ___________________��
�ڷ������A��������________________��
��ijͬѧ��Ʒ������B��װ�ã��гֺͼ���װ������ȥ����ͼ��ʾ���������е�Һ��Ӧ��_____�ڽ������D����E����
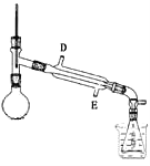
�����йز�����װ�õķ�������ȷ����_____��������ĸ����ѡ���ۣ�
A���ձ���Ӧװ��ˮ
B��������Ӧͨ��ˮ
C��ͼʾװ�ÿ����ڳ�ȥ���������л��е��Ҵ�
���𰸡��ӳɷ�ӦC2H5OSO3H��H2O��C2H5OH+H2SO4CH3COOH+NH3��CH3COONH4CH3COOH+C2H5OH![]() CH3COOC2H5+H2OC2H5OH+CuO
CH3COOC2H5+H2OC2H5OH+CuO![]() CH3CHO+Cu+H2O��ͭ˿����������Ӿ������EA
CH3CHO+Cu+H2O��ͭ˿����������Ӿ������EA
��������
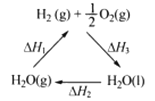
��1����ϩ����̼̼˫���������ᷢ���ӳɷ�Ӧ��������������(CH3CH2��OSO3H)������ԭ���غ��֪����������ˮ�������Ҵ������ᣬ��ת���ܵĻ�ѧ����ʽ��C2H5OSO3H��H2O��C2H5OH+H2SO4��
��2���Ҵ���B��Ӧ����������������B�����ᣬպ��B�IJ�����������������⻯�����就����Ӧ���ɴ���炙�ð���̣���Ӧ�Ļ�ѧ����ʽΪCH3COOH+NH3��CH3COONH4��ת������������Ӧ����Ӧ�Ļ�ѧ����ʽΪCH3COOH+C2H5OH![]() CH3COOC2H5+H2O��
CH3COOC2H5+H2O��
��3����ͭ����ת��Ϊ����ͭ������ͭ���Ҵ���ԭΪͭ����ʹͭ˿�ָ���ɫ�Ļ�ѧ����ʽΪC2H5OH+CuO![]() CH3CHO+Cu+H2O��
CH3CHO+Cu+H2O��
�ڴ�����Ӧǰ���������䣬��Ҫ֤��ͭ˿������ã�����Ҫ���еIJ����ǽ�ͭ˿������أ�
��4���������ǻ��һ������������ӻ�����侧������Ϊ���Ӿ��塣
�ڴ�����Һ�еõ������ǻ��һ����ƹ�����Ҫ���ˣ���������A�������ǹ��ˣ�
������ʱ��ȴˮӦ����������ȴ�����������е�Һ��Ӧ��E�ڽ���A����ȩ�ķе�ϵͣ�Ϊ��ֹ��ȩ�ӷ����ձ���Ӧװ��ˮ��A��ȷ��B��������Ӧͨ��ˮ��B����C����������������ˮ�⣬������ͼʾװ�ó�ȥ���������л��е��Ҵ���C����ѡA��

����Ŀ���п�Ժ��������������ϸ������ij����ַ�������ͼ��ʾ��
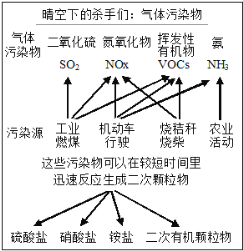

��1��������ͼ��Ϣ���Կ��������е�������Ⱦ�ﲢ���ɻ�������ʻ��ɵ���______����������������ϡȼ����ϵͳ��Ҫ����ԭ��������ͼ��ʾ��д��ϡȼ������NO��������Ҫ��Ӧ�ķ���ʽ_____________________________________��
��2��ũҵ��ų��İ�������ʩ�õĻ��ʷֽ⣬Ҳ������ʩ�ò������µġ�����ijЩ��������Է��ϻ��ʩ�û��ͳ����������ӷ���ʽ����________________________��
��3�������о������ҹ����������ԣ�����Ҫԭ������ͼ��ʾ��A�Ļ�ѧʽ��________��
2NH3(��)+SO2(��)+2NO2(��)![]() 2NH4+(��Һ)+A(��Һ)+2HONO(��)
2NH4+(��Һ)+A(��Һ)+2HONO(��)
��4��úȼ���ŷŵ���������SO2��NOx������NaClO2��Һ��Ϊ���ռ���ͬʱ��������������������������SO2��NOx������ͨ��ʢ��NaClO2��Һ�ķ�Ӧ���У���Ӧһ��ʱ������Һ������Ũ�ȵ��й��������£������������Ӻ��Բ��ƣ���
���� | Na+ | SO42�� | NO���� | H+ | Cl |
Ũ��/��mol��L1�� | 5.5��103 | 8.5��104 | y | 2.8��104 | 3.5��103 |
��NO��NaClO2��Һ��Ӧ�����ӷ���ʽ��___________________��
�ڱ���y��_______��
��5����ҵ��������Ҳ�п��ܲ���NOx��Ⱦ����д�����������еĵ�һ�������Ĵ������Ļ�ѧ����ʽ___________________________________�����õ����ư��IJ���Ϊ90%���ð���������ʱ���Ĵ������͵�������ת��Ϊ������������Ϊ5%��3%��1000 mol��������___________mol���ᡣ