题目内容
【题目】(1)氯化铝水溶液呈______性 ,(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):_____________________;把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是_________。
(2)浓度均为0.1 mol/L的①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵四种溶液中由水电离出的H+浓度由大到小的顺序是_________________________(填序号)。
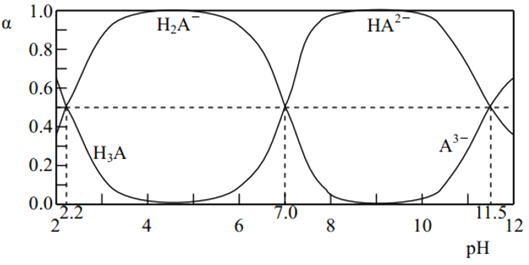
(3)在0.5mol/L的NaHSO3溶液中滴入石蕊,溶液变红,该溶液中HSO3-的电离程度_____HSO3-的水解程度。(填“>”、“=”、“<”)
(4)常温下,将0.2 mol/L CH3COOH和0.1 mol/L NaOH溶液等体积混合,所得溶液的pH<7,该混合溶液中离子浓度由大到小的顺序是______________________________。
(5)相同浓度的下列溶液中,c(CO32-)的大小顺序是_________________(填序号)。
①Na2CO3 ②NaHCO3 ③H2CO3 ④(NH4)2CO3 ⑤NH4HCO3
(6)常温下,用0.01 mol/L HCl溶液完全中和pH=11的下列溶液各100mL,需HCl溶液体积的大小关系是_______________________________(填序号)。
①NaOH ②Ba(OH)2 ③NH3·H2O
【答案】 酸 Al3++3H2O ![]() Al(OH)3+3H+ Al2O3 ④>②>③>① > c(CH3COO-)>c(Na+)>c(H+)>c(OH-) ①>④>②>⑤>③ ③>①=②
Al(OH)3+3H+ Al2O3 ④>②>③>① > c(CH3COO-)>c(Na+)>c(H+)>c(OH-) ①>④>②>⑤>③ ③>①=②
【解析】(1). 氯化铝是强酸弱碱盐,铝离子发生水解:Al3++3H2O ![]() Al(OH)3+3H+,使溶液呈酸性;加热AlCl3溶液时促进铝离子的水解,生成Al(OH)3,Al(OH)3不稳定,灼烧时分解生成Al2O3,故答案为:酸;Al3++3H2O
Al(OH)3+3H+,使溶液呈酸性;加热AlCl3溶液时促进铝离子的水解,生成Al(OH)3,Al(OH)3不稳定,灼烧时分解生成Al2O3,故答案为:酸;Al3++3H2O ![]() Al(OH)3+3H+;Al2O3;
Al(OH)3+3H+;Al2O3;
(2). 浓度均为0.1 mol/L的四种溶液,氯化铵是强酸弱碱盐,水解促进水的电离,醋酸是弱酸,溶液中c(H+)较小,对水的电离抑制程度较小,氢氧化钠是一元强碱,溶液中c(OH-)为0.1mol/L,硫酸是二元强酸,溶液中c(H+)为0.2mol/L,所以硫酸对水的电离抑制程度最大,则四种溶液中由水电离出的c(H+) 由大到小的顺序是④>②>③>①,故答案为:④>②>③>①;
(3). HSO3-的电离使溶液呈酸性,水解使溶液呈碱性,在0.5mol/L的NaHSO3溶液中滴入石蕊,溶液变红,说明溶液呈酸性,所以HSO3-的电离程度大于水解程度,故答案为:>;
(4). CH3COOH溶液的物质的量浓度是NaOH溶液物质的量浓度的2倍,且二者分别是一元酸和一元碱,将两溶液等体积混合,反应后的溶液中含有等物质的量的CH3COOH和CH3COONa,所得溶液的pH<7,说明CH3COOH的电离程度大于CH3COO-的水解程度,所以该混合溶液中离子浓度由大到小的顺序是:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故答案为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-);
(5). Na2CO3和(NH4)2CO3是正盐,在溶液中完全电离出碳酸根离子,所以碳酸根离子的浓度大,由于铵根离子和碳酸根离子会互相促进水解,因此Na2CO3溶液中的碳酸根离子浓度大于(NH4)2CO3溶液中的碳酸根离子浓度, NaHCO3和NH4HCO3是酸式盐,碳酸氢根离子部分电离生成碳酸根离子,由于铵根离子和碳酸氢根离子会互相促进水解,则NH4HCO3溶液中的碳酸氢根离子浓度小,所以NaHCO3溶液中的碳酸根离子浓度大于NH4HCO3溶液中的碳酸根离子浓度,H2CO3是二元弱酸,第二步非常微弱的电离出碳酸根离子,所以碳酸溶液中碳酸根离子浓度最小,综上所述,在相同浓度的这些溶液中,c(CO32-)的大小顺序是:①>④>②>⑤>③,故答案为:①>④>②>⑤>③;
(6). 常温下,pH=11的各溶液中c(OH-)=0.001mol/L,三种溶液的体积都是100mL,加入盐酸溶液发生酸碱中和反应,NaOH、Ba(OH)2是强碱,在溶液中完全电离,因两溶液中氢氧根离子浓度相等,所以二者消耗盐酸溶液的体积相等,NH3·H2O是弱碱,在溶液中只有部分发生电离,溶液中存在大量的NH3·H2O分子,加入盐酸反应时,NH3·H2O会继续电离出氢氧根离子,所以消耗盐酸溶液的体积最大,综上所述,需HCl溶液体积的大小关系是:③>①=②,故答案为:③>①=②。

【题目】T1℃时,向容积为2L的密闭容器中充入一定量的A气体和B气体,发生如下反应:A(g) +2B(g)![]() C(p)。反应过程中测定的部分数据见下表:
C(p)。反应过程中测定的部分数据见下表:
反应时间/min | n(A)/mol | n(B)/ mol |
0 | 1.00 | 1.20 |
10 | 0.50 | |
30 | 0.20 |
下列说法错误的是
A. 前10min内反应的平均速率为v(C)=0.0250 mnol·L-1·min-1
B. 保持其他条件不变,起始时向容器中充入0.50molA气体和0.60mo1B气体,到达平衡时,n(C)<0.25mo1
C. 其他条件不变时,向平衡体系中再充入0.50molA,与原平衡相比,达平衡时B的转化率增大,A的体积分数增大
D. 温度为T2℃时(T1>T2),上述反应平衡常数为20,则正反应为放热反应
【题目】乙醇可由乙烯气相直接水合法或间接水合法生产,一些转化如图。

某些物质的有关数据如下表:
熔点/℃ | 沸点/℃ | 水溶性 | |
乙醇 | -114.1 | 78.3 | 易溶 |
乙醛 | -121 | 20.8 | 易溶 |
乙酸乙酯 | -83 | 77.0 | 难溶 |
回答以下问题:
(1)间接水合法中的转化③:乙烯与浓硫酸反应生成硫酸氢乙酯(CH3CH2—OSO3H)的有机反应类型是_____________,转化④的化学方程式是__________________;
(2)蘸有B的玻璃棒遇到氮的最简单氢化物气体会冒白烟,反应的化学方程式为________,转化⑤的化学方程式为______________________________;
(3)将一质量为w的铜丝灼烧变黑后,迅速插入乙醇中,变黑的铜丝恢复红色。
①使铜丝恢复红色的反应的化学方程式为________________________;
②若要证明铜丝起催化作用,还需要进行的操作是_______________;
(4)已知:CH3CHO + NaHSO3 →![]() ↓(α-羟基乙磺酸钠),如上所得乙醛可用如下方式提纯:
↓(α-羟基乙磺酸钠),如上所得乙醛可用如下方式提纯:
![]()
①α-羟基乙磺酸钠的晶体类型为___________________。
②分离操作A的名称是________________;
③某同学设计分离操作B的装置(夹持和加热装置已略去)如图所示。冷凝管中的液体应从_____口进。(填“D”或“E”)

下列有关操作与装置的分析,正确的是_____。(填字母,多选反扣)
A.烧杯中应装冰水
B.冷凝管应通温水
C.图示装置可用于除去乙酸乙酯中混有的乙醇