��Ŀ����
����Ŀ��Ԫ���ǹ������������������һ�����ʵġ�ԭ���ϡ���
��1����18������������ѧ���Dz���̽��Ԫ��֮�ա�ͨ���Ӿֲ���ϵͳ���о����̣�������Ԫ��֮���������ϵ�������г��˼�λ�ܳ���ѧ�ҵ��о�������
��� | �� | �� | �� | �� |
��ѧ | Ŧ���� | ������ | �±����� | �йŶ��� |
���� | ���֡�����������ָ����ijһָ����Ԫ���𣬵ڰ˸�Ԫ���ǵ�һ��Ԫ�ص�ij���ظ� | ��������ԭ���������ȿ�ʼ���ԭ�������IJⶨ���� | ������5���������Ƶġ���Ԫ���������м�Ԫ�ص����ԭ������Ϊǰ������Ԫ�����ԭ������������ƽ��ֵ | ��Ϊ��Ԫ����֮�䲢�Ǻ�����أ����������ԭ�����������ǰ���С�����˳���� |
������ѧ�ҵ��о�����ʱ���Ⱥ������������_________����������ţ���
��2��1869�꣬�Ž��з���ǰ���о��Ļ������Ƴ��˵�һ��Ԫ�����ڱ�����ͼ��ʾ��
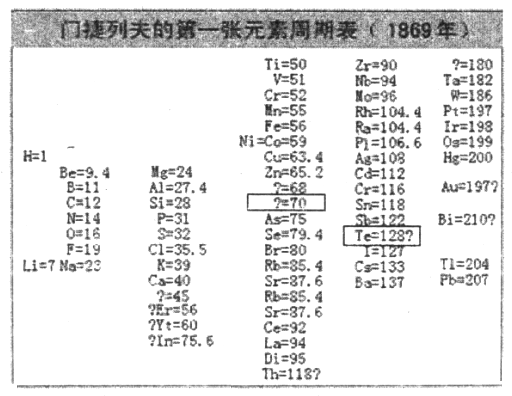
���Ž��з�����Ԫ�ذ������ԭ����������ͬһ___________������С������С���Ԫ���������ơ���ϱ�����Ϣ�������4�з����С�����70�����ʺű���ĺ�����_______________����5�з����С�Te��128�������ʺű���ĺ�����_______________��
�ڵ�20���ͳ����Ž��з����ڱ���Ϊδ֪Ԫ�����µĿ�λ�����������ң�����ԭ�ӽṹ�����أ���ѧ���Ƿ�����Ԫ�����ʲ����������ԭ�������������������Ա仯����������ԭ���������˵�������������������Ա仯���䱾��ԭ����_______________������ĸ��ţ���
A. ���ź˵����������ԭ�Ӻ�������Ų����������Ա仯
B. ���ź˵����������ԭ�Ӱ뾶���������Ա仯
C. ���ź˵����������Ԫ����Ҫ���ϼ۳��������Ա仯
��3��������Ԫ��A��B��D��E��G��J�����ڱ��е�λ�����£�
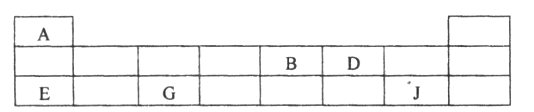
�����ϱ��ش����⣺
��D�����ڱ��е�λ����_______________��
��A��B��E��G��ԭ�Ӱ뾶�ɴ�С��˳����_______________����Ԫ�ط��ţ���
��B��D����̬�⻯����ȶ��Դ�С��ϵΪ_______________���ѧʽ����
��E��G��J������������Ӧˮ��������֮�䷴Ӧ�����ӷ���ʽ�ֱ�Ϊi. H����OH����H2O��ii. _______________��iii_______________��
���õ���ʽ��ʾE�������������γɹ���_______________��
���𰸡� �ڢۢܢ� ���� Ԥ��˴�Ӧ��һ�����ԭ������Ϊ70��Ԫ�� ����Te�����ԭ����������ͬһ�����ԭ���������������˹��ɣ�Te�����ԭ������Ӧ����122��127֮�䣩 A �ڶ����ڣ��ڢ�A�� Na>Al>N>H NH3<H2O Al��OH��3��OH����AlO2����2H2O Al��OH��3��3H����Al3����3H2O ![]()
����������1��1865�꣬Ŧ���ȷ��֡������ɡ���ָ����ijһָ����Ԫ���𣬵ڰ˸�Ԫ���ǵ�һ��Ԫ�ص�ij���ظ���1803�꣬�����ٴ��� ����ԭ���ۣ����ȿ�ʼ���ԭ�������IJⶨ������1829�꣬�±����ɷ�����5���������Ƶġ���Ԫ���顱���м�Ԫ�ص����ԭ������Ϊǰ������Ԫ�����ԭ������������ƽ��ֵ��1862�꣬�йŶ�����Ϊ ��Ԫ����֮�䲢�Ǻ�����أ����������ԭ�����������ǰ���С�����˳��������������ѧ�ҵ��о�����ʱ���Ⱥ�����������Ǣڢۢܢ٣���2���ٽ�ϱ�����Ϣ�ã���������Ԫ�ص����ԭ����������ͬһ����Ԫ���������ƣ���ϱ�����Ϣ�������4�з����С���=70�����ʺű���ĺ��������ԭ������Ϊ70��Ԫ�أ���Te=128��������Te�����ԭ����������128���ʵ�5�з����С�Te=128�������ʺű���ĺ����ǻ���Te�����ԭ����������128���ڿ�ѧ���Ƿ�����Ԫ�����ʲ����������ԭ�������������������Ա仯����������ԭ���������˵�������������������Ա仯���䱾��ԭ�������ź˵����������ԭ�Ӻ�������Ų����������Ա仯���ʴ�Ϊ��A����3��������Ԫ��A��B��D��E��G��J�����ڱ��е�λ�ÿ�֪��A��B��D��E��G��J�ֱ�ΪH��N��O��Na��Al��Cl����O��ԭ�ӽṹ����2�����Ӳ㣬����������Ϊ6����λ�ڵڶ����ڵڢ�A�壻��A��B��E��G��ԭ�Ӱ뾶�ɴ�С��˳����Na>Al>N>H����O�ķǽ����Ա�N��ǿ������N��O����̬�⻯����ȶ��Դ�С��ϵΪNH3<H2O����E��G��J������������Ӧˮ����ֱ�ΪNaOH��Al��OH��3��HClO4������֮�䷴Ӧ�����ӷ���ʽ�ֱ�Ϊi. H����OH����H2O��ii. Al��OH��3��OH����AlO2����2H2O��iii Al��OH��3��3H����Al3����3H2O�����õ���ʽ��ʾE�����������Na2O���γɹ���Ϊ![]() ��
��