题目内容
【题目】下列实验的反应原理用离子方程式表示正确的是
A.室温下,测得氯化铵溶液pH<7,证明一水合氨是弱碱:![]() +2H2O=NH3·H2O+H3O+
+2H2O=NH3·H2O+H3O+
B.用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH+2H2O=2![]() +3H2↑
+3H2↑
C.用碳酸氢钠溶液检验水杨酸中的羧基: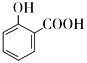 +2
+2![]() →
→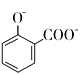 +2H2O+2CO2↑
+2H2O+2CO2↑
D.用高锰酸钾标准溶液滴定草酸:2![]() +16H++5
+16H++5![]() =2Mn2++10CO2↑+8H2O
=2Mn2++10CO2↑+8H2O
【答案】B
【解析】
A.室温下,氯化铵溶液pH<7,是因为NH4+发生水解反应,消耗了水电离产生的OH-,当最终达到平衡时,溶液中c(H+)>c(OH-),但铵根离子水解程度是微弱的,存在水解平衡,离子方程式为:NH4++H2O![]() NH3·H2O+H+,A错误;
NH3·H2O+H+,A错误;
B.单质铝能够与氢氧化钠溶液反应变为可溶性的物质,反应方程式为:2Al+2OH+2H2O=2![]() +3H2↑,而金属镁不能反应,因此可用NaOH溶液除去杂质Al,B正确;
+3H2↑,而金属镁不能反应,因此可用NaOH溶液除去杂质Al,B正确;
C.由于酸性-COOH>H2CO3>-OH,所以碳酸氢钠只能与羧基反应,而与酚羟基不反应,C错误;
D.草酸是二元弱酸,不能写成离子形式,用化学式表示,正确的离子方程式为2![]() +6H++5H2C2O4=2Mn2++10CO2↑+8H2O,D错误;
+6H++5H2C2O4=2Mn2++10CO2↑+8H2O,D错误;
故合理选项是B。

【题目】滴定是一种重要的定量实验方法:
I. 常温下,用0.1000 mol/L NaOH溶液分别滴定20.00 mL 等浓度的盐酸和醋酸溶液,得到两条滴定曲线,如下图所示:
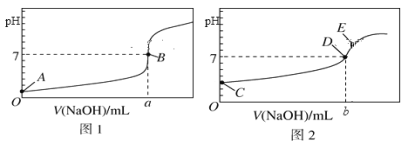
(1)滴定盐酸的曲线是图__________(填“1”或“2”)。
(2)滴定前CH3COOH的电离度为__________(电离度=![]() ×100%)。
×100%)。
(3)达到B、D状态时,反应消耗的NaOH溶液的体积a__________b(填“>”“<”或“=”);若图中E点pH=8,则c(Na+)-c(CH3COO-)的精确值为__________mol/L。
Ⅱ. 现使用酸碱中和滴定法测定市售白醋中醋酸的浓度
(1)实验步骤:
①量取10.00 mL市售白醋,在烧杯中用水稀释后转移到100 mL容量瓶中定容,摇匀得待测白醋溶液。
②用酸式滴定管取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴酚酞作指示剂。
③读取盛装0.1000 mol/L NaOH 溶液的碱式滴定管的初始读数。
④滴定。当___________________时,停止滴定,并记录NaOH溶液的最终读数。
⑤重复②、③、④步骤3次。
数据记录如下:
滴定次数 实验数据(mL) | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
(2)数据处理:
根据实验数据计算,可得市售白醋中醋酸的浓度为_________ mol/L
(3)误差在本实验的滴定过程中,下列操作会使实验结果偏大的是_________。
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后消失
c.锥形瓶中加入待测白醋溶液后,再加入少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
e.滴定前平视读数,滴定后俯视读数