题目内容
用浓硫酸配制一定物质的量浓度的硫酸溶液,下列操作会造成所配溶液浓度偏高的是( )
| A.溶解后的溶液未冷却至室温就转移入容量瓶中 |
| B.反复倒转摇匀后,液面低于刻度线,再加蒸馏水至液面最低点恰好与刻度线相平 |
| C.洗涤烧杯和玻璃棒的溶液转移入容量瓶中 |
| D.定容时,眼睛仰视刻度线 |
A
解析试题分析:根据cB=nB/V可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量nB和溶液的体积V引起的。溶解后的溶液未冷却至室温就转移入容量瓶中,则根据热胀冷缩可知,冷却到室温后,容量瓶中溶液的体积减少,所以浓度偏高,A正确;反复倒转摇匀后,液面低于刻度线,再加蒸馏水至液面最低点恰好与刻度线相平,则容量瓶中溶液的体积增加,浓度偏小,B不正确;洗涤烧杯和玻璃棒的溶液转移入容量瓶中,属于正确的操作,浓度不受影响,C不正确;定容时,眼睛仰视刻度线,则容量瓶中溶液的体积增加,浓度偏小,D不正确,答案选A。
考点:考查物质的量浓度溶液配制的误差分析
点评:该题是中等难度的试题,也是高考中的常见题型,侧重对学生灵活运用基础知识解决实际问题的能力的培养。误差分析时,关键要看配制过程中引起n和V怎样的变化。在配制一定物质的量浓度溶液时,若nB比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若nB比理论值大,或V比理论值小时,都会使所配溶液浓度偏大。

练习册系列答案
相关题目
NA表示阿伏加德罗常数值。下列说法正确的是
| A.1mol Na2O2与足量CO2充分反应转移的电子数为2NA |
| B.常温下,pH=1的醋酸溶液中,醋酸分子的数目一定大于0.1NA |
| C.向FeI2溶液中通入适量氯气,当有1mol Fe2+被氧化时,总共转移电子的数目为NA |
| D.t℃时,1L pH=6的纯水中,含1×10—6 NA个OH— |
设NA为阿伏伽德罗常数的数值,下列说法中,正确的是
| A.标准状况下,22.4L Cl2完全溶于水时,转移的电子数为NA |
| B.常温下,1L pH=1的H2SO4溶液中含有H+的数目为0.2NA |
| C.标准状况下,2.24LNH3中含有的共价键数目为NA |
| D.常温下,23gNO2和N2O4的混合气体中含有NA个氧原子 |
下列化学用语表达正确的是
A.磷原子的原子结构示意图: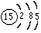 |
B.钠离子的电子式: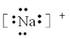 |
C.甲烷的结构式: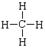 |
| D.质子数为8,中子数为10的核素:10O |
已知气体的摩尔质量越小,扩散速度越快。如图所示为气体扩散速度的实验,两种气体扩散相遇时形成白色烟环。下列关于甲、乙的判断正确的是
| A.甲是浓氨水,乙是浓硫酸 |
| B.甲是浓盐酸,乙是浓氨水 |
| C.甲是浓氨水,乙是浓盐酸 |
| D.甲是浓硝酸,乙是浓氨水 |
加碘盐的主要成分是NaCl,还添加了适量的KIO3。下列说法中正确的是
| A.KIO3和NaCl为离子化合物,均只含离子键 |
B.KIO3中阳离子的结构示意图为 |
| C.23Na37Cl中质子数和中子数之比是8∶7 |
| D.次碘酸的结构式为H—O—I |
下列有关化学用语表示正确的是
A.比例模型 可以表示水分子,也可以表示二氧化碳分子 可以表示水分子,也可以表示二氧化碳分子 |
B.电子式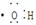 可以表示羟基,也可以表示氢氧根离子 可以表示羟基,也可以表示氢氧根离子 |
C.离子结构示意图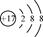 可以表示35Cl-,也可以表示37Cl- 可以表示35Cl-,也可以表示37Cl- |
D.离子方程式HCO3-+H2O H3O+ +CO32-可以表示HCO3-离子的水解,也可以表示它的电离 H3O+ +CO32-可以表示HCO3-离子的水解,也可以表示它的电离 |