题目内容
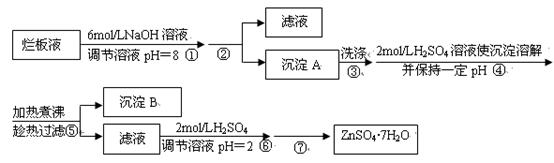
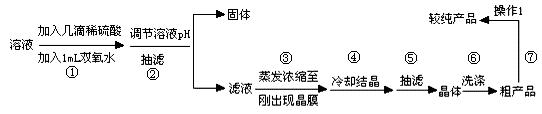
“烂板液”是制印刷锌板时,用稀HNO3腐蚀锌板后得到的废液,主要含Zn(NO3)2和由自来水带进的Cl-、Fe3+等杂质离子。在实验室中由“烂板液”制取ZnSO4·7H2O的过程如下:
已知有关金属离子形成氢氧化物沉淀时的pH见下表:
(1)沉淀B的主要成分是 。
(2)第②步操作中需要的玻璃仪器有 。
(3)第④步中pH应保持在 范围内。
(4)第⑥步调节溶液pH=2的目的是 。
(5)操作⑦包含3个基本实验操作,它们是蒸发浓缩、 和过滤。

已知有关金属离子形成氢氧化物沉淀时的pH见下表:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe3+ | 1.9 | 3.2 |
| Zn2+ | 6.4 | 8.0 |
(2)第②步操作中需要的玻璃仪器有 。
(3)第④步中pH应保持在 范围内。
(4)第⑥步调节溶液pH=2的目的是 。
(5)操作⑦包含3个基本实验操作,它们是蒸发浓缩、 和过滤。
⑴Fe(OH)3 ⑵漏斗、玻璃棒、烧杯 ⑶3.2~6.4 ⑷抑制Zn2+水解
⑸冷却结晶(或降温结晶)
⑸冷却结晶(或降温结晶)
略

练习册系列答案
相关题目


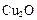 可作为太阳光分解水的催化剂。
可作为太阳光分解水的催化剂。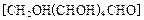 还原新制的
还原新制的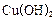 。写出化学方程式 ;
。写出化学方程式 ;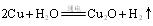 。则阳极产物是 ;
。则阳极产物是 ;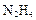 )还原新制
)还原新制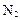 。该制法的化学方程式为 。
。该制法的化学方程式为 。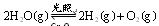 ;△H= +484kJ/mol,不同时段产生
;△H= +484kJ/mol,不同时段产生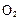 的量见下表:
的量见下表: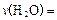 ;达平衡时,至少需要吸收的光能为 kJ。
;达平衡时,至少需要吸收的光能为 kJ。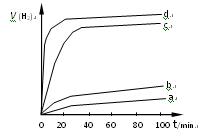
 CO↑ + CO2↑ + H2O,下列装置中,可用作草酸分解制取气体的是 ▲ 。(填字母)
CO↑ + CO2↑ + H2O,下列装置中,可用作草酸分解制取气体的是 ▲ 。(填字母)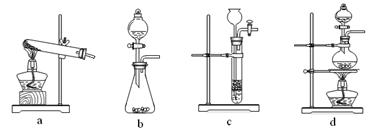
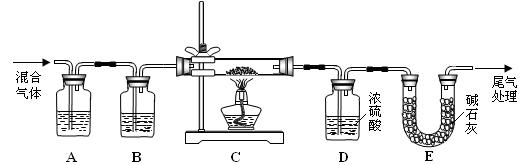
 进行的操作是:(a)检查装置气密性;(b) ▲ 。
进行的操作是:(a)检查装置气密性;(b) ▲ 。