题目内容
(14分)某研究性学习小组欲利用所学知识制备并提纯硫酸铜。所用原料为废旧铜材(含铁约2%,其它杂质忽略不计),过程如下:
I:制备硫酸铜
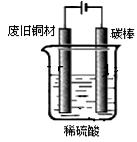
装置如图,写出阳极发生的电极反应式 、 。
II:提纯硫酸铜
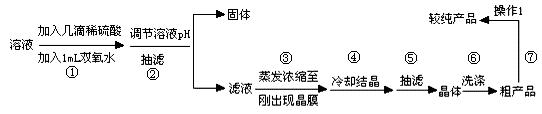
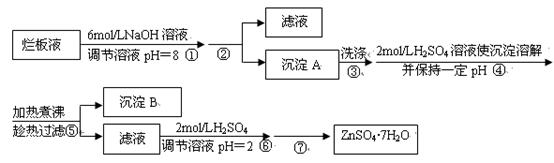
待反应结束后,取出电极,按照如下流程提纯得到硫酸铜晶体(CuSO4·5H2O)
已知此溶液中Fe2+、Fe3+、Cu2+形成氢氧化物的pH如下表
(1)写出步骤①发生反应的离子方程式 。
(2)步骤②中可加入 (填化学式)调节溶液pH至 (填范围)。
(3)步骤③不能蒸干的原因是 。
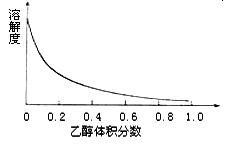
(4)下图表示硫酸铜晶体在乙醇水混合溶剂中溶解度随乙醇体积分数的变化曲线,则最适合作为步骤⑥洗涤液是 。
(5)操作1的名称是 。
I:制备硫酸铜

装置如图,写出阳极发生的电极反应式 、 。
II:提纯硫酸铜
待反应结束后,取出电极,按照如下流程提纯得到硫酸铜晶体(CuSO4·5H2O)

已知此溶液中Fe2+、Fe3+、Cu2+形成氢氧化物的pH如下表
| 离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe2+ | 6.4 | 8.4 |
| Fe3+ | 2.4 | 3.1 |
| Cu2+ | 5.2 | 6.5 |
(2)步骤②中可加入 (填化学式)调节溶液pH至 (填范围)。
(3)步骤③不能蒸干的原因是 。
(4)下图表示硫酸铜晶体在乙醇水混合溶剂中溶解度随乙醇体积分数的变化曲线,则最适合作为步骤⑥洗涤液是 。

| A.无水乙醇 | B.蒸馏水 |
| C.95%乙醇溶液 | D.饱和硫酸钠溶液 |
(14分) I. Fe-2e-=Fe2+(1分) Cu-2e-=Cu2+(1分)
II.(1)2Fe2++2H++H2O2=2Fe3++2H2O(2分)
(2)CuO、CuCO3、Cu2(OH)2CO3(任写一种)(2分)
3.1~5.2(只要是这个区间内的都给分)(2分)
(3)防止硫酸铜晶体失去结晶水(2分) (4)C (2分) (5)重结晶(2分)
II.(1)2Fe2++2H++H2O2=2Fe3++2H2O(2分)
(2)CuO、CuCO3、Cu2(OH)2CO3(任写一种)(2分)
3.1~5.2(只要是这个区间内的都给分)(2分)
(3)防止硫酸铜晶体失去结晶水(2分) (4)C (2分) (5)重结晶(2分)
略

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 l2+2H2SO4
l2+2H2SO4 2CaSO4+2Cl2↑+2H2O他们设计了如图所示装置制取氯气并验证其性质的实验。
2CaSO4+2Cl2↑+2H2O他们设计了如图所示装置制取氯气并验证其性质的实验。
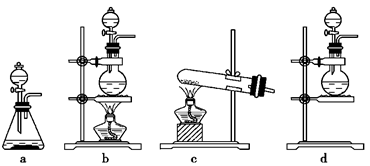
 ________________ 。
________________ 。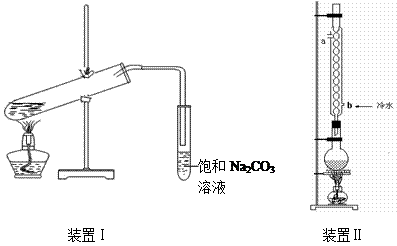
 从装置Ⅰ中右侧小试管中分离出乙酸乙酯,应进行的操作是:撤出小试管,将混合液倒入 (填仪器名称),用力振
从装置Ⅰ中右侧小试管中分离出乙酸乙酯,应进行的操作是:撤出小试管,将混合液倒入 (填仪器名称),用力振
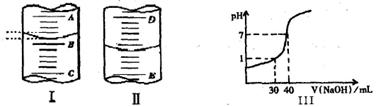
 液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填代号)_
液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填代号)_ _________。
_________。
 滴定后气泡消失
滴定后气泡消失
 以上步骤中:验证沉淀已洗涤干净的方法是_______________________________________。
以上步骤中:验证沉淀已洗涤干净的方法是_______________________________________。