题目内容
【题目】“在2支大小相同的试管中各装入2~3mL约5%的H2O2溶液,再向其中1支试管中滴入1~2滴1mol/L FeCl3溶液,对比观察现象.” Ⅰ.体验H2O2分解的实验意义
(1)指出本实验的探究目的:
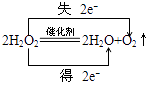
(2)写出H2O2分解反应方程式并标出电子转移的方向和数目:
(3)在盛有滴入FeCl3溶液的H2O2溶液中,可观察到溶液中;溶液温度升高;溶液由浅黄色变成棕黄色,最后恢复为浅黄色.
(4)Ⅱ.探讨FeCl3催化H2O2分解的机理 Fe3+催化H2O2分解时涉及2步反应:
第1步,Fe3+氧化H2O2:2Fe3++H2O2═2Fe2++O2↑+2H+
第2步,H2O2氧化Fe2+:(用离子方程式表示)
【答案】
(1)FeCl3对H2O2分解速率的影响
(2)
(3)产出大量气泡
(4)2Fe2++H2O2+2H+═2Fe3++2H2O
【解析】解:(1)H2O2能分解生成水和氧气,在2支大小相同的试管中各装入2~3mL约5%的H2O2溶液,再向其中1支试管中滴入1~2滴1mol/L FeCl3溶液,则该实验是探究FeCl3对H2O2分解速率的影响;所以答案是:FeCl3对H2O2分解速率的影响;(2)H2O2分解生成水和氧气,H2O2中O元素的化合价部分从﹣1价变为0价,部分变为﹣2价,则反应中电子转移的方向和数目  ;所以答案是:
;所以答案是:  ;(3)FeCl3的催化作用下双氧水分解生成氧气,所以在盛有滴入FeCl3溶液的H2O2溶液中,会有大量氧气生成,可观察到溶液中产生大量气泡;所以答案是:产生大量气泡;(4)H2O2把Fe2+氧化为2Fe3+ , 自身被还原为水,反应的离子方程式为:2Fe2++H2O2+2H+═2Fe3++2H2O;所以答案是:2Fe2++H2O2+2H+═2Fe3++2H2O.
;(3)FeCl3的催化作用下双氧水分解生成氧气,所以在盛有滴入FeCl3溶液的H2O2溶液中,会有大量氧气生成,可观察到溶液中产生大量气泡;所以答案是:产生大量气泡;(4)H2O2把Fe2+氧化为2Fe3+ , 自身被还原为水,反应的离子方程式为:2Fe2++H2O2+2H+═2Fe3++2H2O;所以答案是:2Fe2++H2O2+2H+═2Fe3++2H2O.

【题目】某化学反应2AB+D在三种不同条件下进行,B、D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如表所示,表中温度为摄氏度(℃).
实验 | 浓度 时间 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | c1 | 0.50 |
2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | T3 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,回答下列问题:
(1)在实验1中,以反应物A浓度的变化表示该反应在0~10min内的平均反应速率为
(2)在实验1中,c1数值为
(3)在实验1、2中有一个实验使用了正催化剂.判断是实验(选填“1”或“2”)使用了正催化剂.
(4)在实验1、3中反应温度不同.判断T3800(选填“<”或“>”).