题目内容
【题目】下列说法正确的是( )
A.氢气的燃烧热为△H=﹣285.5kJ?mol﹣1 , 则电解水的热化学方程式为2H2O(l) ![]() 2H2(g)+O2(g)△H=+285.5k?Jmol﹣1
2H2(g)+O2(g)△H=+285.5k?Jmol﹣1
B.反应SO2(g)+2H2S(g)═3S(s)+2H2O(l)在常温下能自发进行,则该反应的△H<0
C.500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)═2NH3(g)△H=﹣38.6k?Jmol﹣1
D.由C(石墨,s)=C(金刚石,s)△H=+1.90 k?Jmol﹣1可知,金刚石比石墨稳定
【答案】B
【解析】解:A、燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,所以水分解的热化学方程式:H2O(l)=H2(g)+ ![]() O2(g)△H=+285.5 kJmol﹣1 , 但是电解水的热化学方程式中,根据能量守恒,电能的介入会导致热能减少,吸收的热量变小,故A错误;
O2(g)△H=+285.5 kJmol﹣1 , 但是电解水的热化学方程式中,根据能量守恒,电能的介入会导致热能减少,吸收的热量变小,故A错误;
B.反应SO2(g)+2H2S(g)═3S(s)+2H2O(l)在常温下能自发进行,满足△H﹣T△S<0,反应△S<0,则该反应的△H<0,故B正确;
C.0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,因反应为可逆反应,则1molN2和3molH2置于密闭的容器中充分反应生成NH3(g),放热不是38.6kJ,则热化学反应方程式中的反应热数值错误,故C错误;
D.由C(石墨,s)=C(金刚石,s)△H=+1.90 kJmol﹣1可知,反应过程是吸热反应,金刚石能量高于石墨,则说明石墨比金刚石稳定,故D错误;
故选B.
【考点精析】利用反应热和焓变对题目进行判断即可得到答案,需要熟知在化学反应中放出或吸收的热量,通常叫反应热.

 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t/°C | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=_________________。
(2)该反应为________反应(填“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是(____)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为_______℃。
【题目】炼锌厂产生的工业废渣——锌渣(除了含Zn 外,还含有Fe、Al、Cd (镉)和SiO2等杂质),利用锌渣制取并回收ZnSO4·7H2O 和金属镉(Cd)是一个有益的尝试,流程如下:
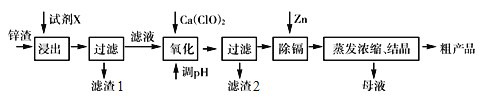
已知:金属活动性Zn> Cd
物质 | Fe(OH)3 | Al(OH)3 | Zn(OH)2 | Cd(OH)2 | Fe(OH)2 |
完全沉淀时的PH | ≥3.2 | ≥4.7 | ≥6.5 | ≥9.4 | ≥9.7 |
试回答下列问题:
(1)第一步浸出时用到的试剂X为__________,滤渣1的成分是___________。
(2)加入Ca(ClO)2 的目的是氧化Fe2+,写出反应的离子方程式____________________。
(3)调节pH 过程可以选用;本流程的pH 调节一般调至5,其目的是_____________________。
(4)写出过滤后加入过量的锌粉反应的离子方程式__________________。
(5)在蒸发浓缩操作时,要保持一定的酸度,其目的是______。
