��Ŀ����
����Ŀ����п�������Ĺ�ҵ��������п��(���˺�Zn �⣬������Fe��Al��Cd ���ӣ���SiO2������)������п����ȡ������ZnSO4��7H2O �ͽ�����(Cd)��һ������ij��ԣ��������£�
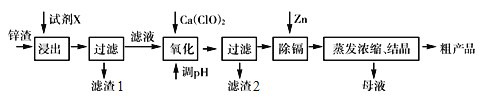
��֪���������Zn> Cd
���� | Fe(OH)3 | Al(OH)3 | Zn(OH)2 | Cd(OH)2 | Fe(OH)2 |
��ȫ����ʱ��PH | ��3.2 | ��4.7 | ��6.5 | ��9.4 | ��9.7 |
�Իش��������⣺
(1)��һ������ʱ�õ����Լ�XΪ__________������1�ijɷ���___________��
(2)����Ca(ClO)2 ��Ŀ��������Fe2+��д����Ӧ�����ӷ���ʽ____________________��
(3)����pH ���̿���ѡ�ã������̵�pH ����һ�����5����Ŀ����_____________________��
(4)д�����˺���������п�۷�Ӧ�����ӷ���ʽ__________________��
(5)������Ũ������ʱ��Ҫ����һ������ȣ���Ŀ����______��
���𰸡� H2SO4��Һ SiO2 2H++ClO��+2Fe2+ =Cl��+2Fe3++H2O ZnO��ȥFe3+��Al3+����ֹZn2+�������� Zn+Cd2+== Zn2++Cd ��ֹZn2+ˮ��
��������(1).Zn��Fe��Al��Cd��SiO2�У�ֻ�ж������費�ܺ����ᷴӦ�����������Ὣ֮�ܽ⣬���ˣ��Ȼ�ö������裬�ʴ�Ϊ��H2SO4��Һ��SiO2��
(2).Ϊ�˽������������Լ����������ӳ���������������ӳ���������������Ҫ��������������Ϊ������������Ȼ���ٽ�֮�γɳ�������Ӧʵ���ǣ�2H++ClO-+2Fe2+ =Cl-+2Fe3++H2O���ʴ�Ϊ��2H++ClO-+2Fe2+ =Cl-+2Fe3++H2O��
(3).������pH��������ʹ����Һ�ļ�����ǿ��ͬʱ�ֲ��������������ӣ��ݴ˿���ѡ������п�����Լ����Խ����������Ӻ������ӳ����������γ�Fe(OH)3��Al(OH)3��ͬʱ�����Է�ֹZn2+�����������ʴ�Ϊ��ZnO����ȥFe3+��Al3+����ֹZn2+����������
(4).����Cd�Ļ����ԱȽ���п������ý���п���û�����������Ӧ�����ӷ���ʽΪ��Zn+Cd2+== Zn2++Cd���ʴ�Ϊ��Zn+Cd2+== Zn2++Cd��
(5).������п��Һ�л�ô���������п�ľ���ķ����Ǽ���Ũ������ȴ�ᾧ��������ϴ�ӣ�����Ҫע�Ᵽ����Һһ������ȣ��Է�ֹZn2+��ˮ�⣬�ʴ�Ϊ����ֹZn2+ˮ����

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�