题目内容
【题目】温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,发生反应:
PCl5(g)=====PCl3(g)+Cl2(g) △H=akJ/mol(a>0)
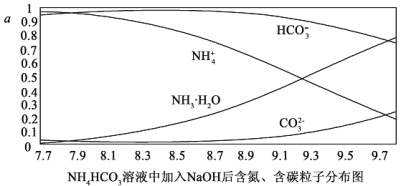
0~10min保持容器温度不变,10min时改变一种条件,整个过程中PCl5、PCl3、Cl2的物质的量随时间的变化如图所示。下列说法正确的是

A. 0~4min的平均速率v(Cl2)=0.05mol/(L·min )
B. 10min时改变的条件是分离出一定量的PCl5
C. 起始时向该容器中充入2.0mol PCl3和2.0molCl2,保持温度为T,反应达平衡时放出的热量大于1.6akJ
D. 温度为T,起始时向该容器中充入1.0mol PCl5、0.10mol PCl3和0.10molCl2,反应达到平衡前,v(正)>v(逆)
【答案】CD
【解析】A、 0~4min的平均速率v(Cl2)=![]() mol/(L·min ),故A错误;B、10min时改变的条件是升温,故B错误;C、从图中读出起始时向该容器中充入1.0mol PCl3和1.0molCl2,保持温度为T,转化率为1-20%=80%,当起始时向该容器中充入2.0mol PCl3和2.0molCl2,保持温度为T,相当于加压,故转化率大于80%,反应达平衡时放出的热量大于1.6akJ,故C正确;D、
mol/(L·min ),故A错误;B、10min时改变的条件是升温,故B错误;C、从图中读出起始时向该容器中充入1.0mol PCl3和1.0molCl2,保持温度为T,转化率为1-20%=80%,当起始时向该容器中充入2.0mol PCl3和2.0molCl2,保持温度为T,相当于加压,故转化率大于80%,反应达平衡时放出的热量大于1.6akJ,故C正确;D、![]() ,
,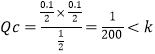 ,反应正向进行,v(正)>v(逆),故D正确,故选CD。
,反应正向进行,v(正)>v(逆),故D正确,故选CD。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目