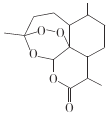
题目内容
【题目】下列关于Fe3+、Fe2+性质实验的说法正确的是( )
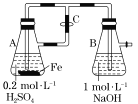
A.用如图装置不可以制备沉淀Fe(OH)2
B.配制FeCl3溶液时,直接将FeCl3晶体溶于水即可
C.向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色,此现象确定溶液中含有Fe2+
D.向FeCl2溶液中加入少量铁粉是为了防止Fe2+被氧化
【答案】CD
【解析】
A.装置A中发生Fe与稀硫酸的反应生成硫酸亚铁和氢气,利用氢气将装置中的空气排出,然后关闭C,氢气将硫酸亚铁压入B中,硫酸亚铁与NaOH反应生成Fe(OH)2,该装置能防止Fe(OH)2被氧化,故A错误;
B.FeCl3易水解,配制溶液时应防止溶液因水解而生成氢氧化铁沉淀,可先将氯化铁晶体溶于较浓的盐酸中,再加水稀释到所需要的浓度,故B错误;
C.Fe3+可以与KSCN溶液作用显红色,开始滴加KSCN溶液不变色,说明溶液中没有Fe3+,滴加氯水后显红色,说明原溶液中有Fe2+,被氯水氧化成Fe3+使溶液显红色,故C正确;
D.Fe3+与铁反应可生成Fe2+,则向FeCl2溶液中加入少量铁粉是为了防止Fe2+被氧化,故D正确;
故答案为CD。

【题目】某小组在实验室中探究金属钠与二氧化碳的反应。回答下列问题:

(1)选用如图所示装置及药品制取CO2。打开弹簧夹,制取CO2。为了得到干燥.纯净的CO2,产生的气流应依次通过盛有_________的洗气瓶(填试剂名称)。反应结束后,关闭弹簧夹,可观察到的现象是____________________________。不能用稀硫酸代替稀盐酸,其原因是______________________________。
(2)金属钠与二氧化碳反应的实验步骤及现象如下表:
步骤 | 现象 |
将一小块金属钠在燃烧匙中点燃,迅速伸入盛有CO2的集气瓶中。充分反应,放置冷却 | 产生大量白烟,集气瓶底部有黑色固体产生,瓶壁上有白色物质产生 |
在集气瓶中加入适量蒸馏水,振荡.过滤 | 滤纸上留下黑色固体,滤液为无色溶液 |
①为检验集气瓶瓶壁上白色物质的成分,取适量滤液于2支试管中,向一支试管中滴加1滴酚酞溶液,溶液变红:向第二支试管中滴加澄清石灰水,溶液变浑浊。
据此推断,白色物质的主要成分是________(填标号)。
A.Na2O B.Na2O2 C.NaOH D.Na2CO3
②为检验黑色固体的成分,将其与浓硫酸反应,生成的气体具有刺激性气味。据此推断黑色固体是________________。
③本实验中金属钠与二氧化碳反应的化学方程式为_______________________。