题目内容
8.下列有关实验的操作方法中,正确的是F(填写序号)A.Na2CO3溶液保存在带玻璃塞的试剂瓶中;
B.不慎将酒精撒到桌面上引起着火,应立即用较多的水浇灭;
C.配置H2SO4溶液时,先在量筒中加一定体积的水,再在搅拌下慢慢加入浓H2SO4;
D.加热后的试管立即用水冲洗;
E.取用无腐蚀性的固体药品,可用手直接拿取;
F.用结晶法可除去硝酸钾中混有的少量氯化钠;
G.在氯化铁溶液中,滴加氢氧化钠溶液,可以制得氢氧化铁胶体.
分析 A.碳酸根离子水解显碱性;
B.酒精与水混溶,失火不能用水浇灭;
C.量筒不能作反应容器;
D.立即用水冲洗,试管会炸裂;
E.不能用手接触药品;
F.硝酸钾固体的溶解度随温度的升高明显增大,氯化钠固体的溶解度受温度变化影响较小;
G.将氯化铁饱和溶液逐滴加入沸水中,制得氢氧化铁胶体溶液.
解答 解:A.碳酸根离子水解显碱性,和玻璃中的二氧化硅反应,生成硅酸钠是矿物胶粘结瓶口和瓶塞,故A错误;
B.洒在桌上的酒精燃烧起来,酒精与水混溶,失火不能用水灭,应立即用湿抹布扑盖,故B错误;
C.量筒不能作反应容器,受热不均,可能会炸裂,故C错误;
D.立即用水冲洗,试管会炸裂,应冷却后再洗,故D错误;
E.实验室中的药品或有毒或有腐蚀性,不能用手接触药品,故E错误;
F.硝酸钾固体的溶解度随温度的升高明显增大,氯化钠固体的溶解度受温度变化影响较小,如提纯硝酸钾,就要让它成为晶体析出,所以先溶解,然后用降温结晶的方法,然后过滤得到硝酸钾,故F正确;
G.制备氢氧化铁胶体用加热饱和氯化铁溶液的方法制备,向氯化铁溶液里滴入氢氧化钠溶液,得到氢氧化铁沉淀,故G错误;
故选F.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质的保存、实验安全、胶体的制备等,侧重实验基本操作和实验原理的考查,注意装置的作用及实验的操作性、评价性分析,题目难度不大.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
19.用CH4催化还原NOx可以消除氮氧化物的污染.例如:
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
下列说法不正确的是( )
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
下列说法不正确的是( )
| A. | 反应①②均为放热反应 | |
| B. | 反应①②转移的电子数相同 | |
| C. | 若用标准状况下4.48L CH4还原NO2至N2,放出的热量是173.4kJ | |
| D. | 由反应①可推知:CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(l)△H=-akJ•mol-1,a<574 |
16.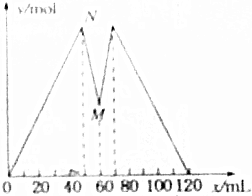 如图所示是向MgCl2和AlCl3的混合溶液中加入NaOH溶液和盐酸时,沉淀的物质的量y(mol)与加入NaOH溶和盐酸的体积x(mL)的关系图.根据图示判断,下列结论中不正确的是( )
如图所示是向MgCl2和AlCl3的混合溶液中加入NaOH溶液和盐酸时,沉淀的物质的量y(mol)与加入NaOH溶和盐酸的体积x(mL)的关系图.根据图示判断,下列结论中不正确的是( )
 如图所示是向MgCl2和AlCl3的混合溶液中加入NaOH溶液和盐酸时,沉淀的物质的量y(mol)与加入NaOH溶和盐酸的体积x(mL)的关系图.根据图示判断,下列结论中不正确的是( )
如图所示是向MgCl2和AlCl3的混合溶液中加入NaOH溶液和盐酸时,沉淀的物质的量y(mol)与加入NaOH溶和盐酸的体积x(mL)的关系图.根据图示判断,下列结论中不正确的是( )| A. | N点时溶液中的溶质只有NaCl | |
| B. | 原混合溶液中c(MgCl2):c(AlCl3)=1:2 | |
| C. | c(NaOH)=c(HCl) | |
| D. | M点之前加入的是NaOH溶液,M点之后加入的是盐酸 |
3.设NA为阿伏伽德罗常数,下列说法错误的是( )
| A. | 1mol H2O所含电子数为10NA | |
| B. | 1mol Al与足量的稀盐酸溶液反应生成氢气1.5mol | |
| C. | 在标准状况下,0.5NA Cl2所占的体积约是11.2L | |
| D. | 在非标准状况下,22.4L O2含有的分子数一定不是NA |
13.向21.6g铁粉和铜粉的混合物中加入1L 1mol/L HNO3,充分反应,放出NO气体且金属有剩余,则反应后溶液中c(NO3-)为(忽略溶液体积的变化)( )
| A. | 0.45mol/L | B. | 0.6mol/L | C. | 0.75mol/L | D. | 0.9mol/L |
6. S2Cl2是工业上常用的硫化剂,可以改变生橡胶受热发粘、遇冷变硬的性质.
S2Cl2是工业上常用的硫化剂,可以改变生橡胶受热发粘、遇冷变硬的性质.
已知:①S2Cl2易与水反应;②300℃以上完全分解;③微热的情况下S2Cl2能被过量Cl2氧化S2Cl2+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$ 2SCl2;④有关物质的熔沸点如下:
实验室制备S2Cl2的反应原理有两种:
①CS2+3C12$\frac{\underline{\;95-100℃\;}}{\;}$CC14+S2Cl2; ②2S+Cl2$\frac{\underline{\;111-140℃\;}}{\;}$S2Cl2.
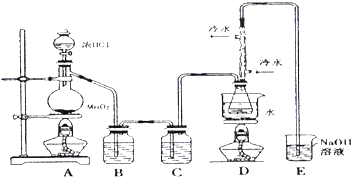
(1)若实验室选择如图装置(部分夹持装置已略去)来制备S2Cl2,其反应原理是上述中的①(填写序号);上图中尾气处理装置不够完善,改进后的装置应起到的作用是:在D、E之间再加一个干燥装置,同时要能吸收尾气、防倒吸.利用改进后的正确装置进行实验,请回答以下问题
(2)为了提高产品S2Cl2的纯度,实验操作的关键是控制好温度和控制浓盐酸的滴速不能太快.
(3)该实验的操作顺序为:①③②⑤④(用序号表示).
①点燃酒精灯A ②点燃酒精灯D ③通冷凝水 ④熄灭酒精灯A ⑤熄灭酒精灯D
(4)D装置中冲凝管的作用是:冷凝回流、导气;反应结束后,从D装置锥形瓶内的混合物中分离出产物的方法是:蒸馏;某同学取少量产物,小心加入适量水中,观察到有白雾,黄色沉淀、产生的无色气体能使品红
溶液褪色,该同学据此判断.上述实验确有S2Cl2生成,写出S2Cl2与水反应的化学方程式:2S2Cl2+2H2O=S↓+SO2↑+4HCl
(5)S2Cl2中每个原子的最外层都具有8电子结构,请写出S2Cl2的电子式: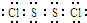 .
.
 S2Cl2是工业上常用的硫化剂,可以改变生橡胶受热发粘、遇冷变硬的性质.
S2Cl2是工业上常用的硫化剂,可以改变生橡胶受热发粘、遇冷变硬的性质.已知:①S2Cl2易与水反应;②300℃以上完全分解;③微热的情况下S2Cl2能被过量Cl2氧化S2Cl2+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$ 2SCl2;④有关物质的熔沸点如下:
| 物质 | 沸点/℃ | 熔点/℃ |
| S | 445 | 113 |
| CS2 | 47 | -109 |
| CCl4 | 77 | -23 |
| S2Cl2 | 137 | -77 |
①CS2+3C12$\frac{\underline{\;95-100℃\;}}{\;}$CC14+S2Cl2; ②2S+Cl2$\frac{\underline{\;111-140℃\;}}{\;}$S2Cl2.
(1)若实验室选择如图装置(部分夹持装置已略去)来制备S2Cl2,其反应原理是上述中的①(填写序号);上图中尾气处理装置不够完善,改进后的装置应起到的作用是:在D、E之间再加一个干燥装置,同时要能吸收尾气、防倒吸.利用改进后的正确装置进行实验,请回答以下问题
(2)为了提高产品S2Cl2的纯度,实验操作的关键是控制好温度和控制浓盐酸的滴速不能太快.
(3)该实验的操作顺序为:①③②⑤④(用序号表示).
①点燃酒精灯A ②点燃酒精灯D ③通冷凝水 ④熄灭酒精灯A ⑤熄灭酒精灯D
(4)D装置中冲凝管的作用是:冷凝回流、导气;反应结束后,从D装置锥形瓶内的混合物中分离出产物的方法是:蒸馏;某同学取少量产物,小心加入适量水中,观察到有白雾,黄色沉淀、产生的无色气体能使品红
溶液褪色,该同学据此判断.上述实验确有S2Cl2生成,写出S2Cl2与水反应的化学方程式:2S2Cl2+2H2O=S↓+SO2↑+4HCl
(5)S2Cl2中每个原子的最外层都具有8电子结构,请写出S2Cl2的电子式:
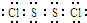 .
.
3.欲将粗盐提纯用所得精盐配制一定质量分数的氯化钠溶液,下列说法正确的是( )
| A. | 粗盐过滤时,用玻璃棒搅拌加快过滤的速度 | |
| B. | 蒸发滤液时,待蒸发皿中滤液蒸干时停止加热 | |
| C. | 配制溶液时必须使用的仪器有托盘天平、酒精灯、量筒、烧杯、玻璃棒等 | |
| D. | 配制溶液需要经过计算、称量、溶解、装瓶贴标签等步骤 |
4.有如下反应

下列说法正确的是( )

下列说法正确的是( )
| A. | 荧光素属于高分子化合物 | |
| B. | 荧光素与氧化荧光素都至少有6个碳原子共平面 | |
| C. | 荧光素与氧化荧光素都能与碳酸氢钠反应 | |
| D. | 荧光素与氧化荧光素互为同系物 |