题目内容
13.向21.6g铁粉和铜粉的混合物中加入1L 1mol/L HNO3,充分反应,放出NO气体且金属有剩余,则反应后溶液中c(NO3-)为(忽略溶液体积的变化)( )| A. | 0.45mol/L | B. | 0.6mol/L | C. | 0.75mol/L | D. | 0.9mol/L |
分析 由于反应后有金属剩余,即反应后所得溶液中不可能含有Fe3+,生成物中金属离子均为+2价.设金属为M,生成的硝酸盐为M(NO3)2,发生反应:3M+8HNO3(稀)═3M(NO3)2+2NO↑+4H2O,硝酸根在反应中有$\frac{1}{4}$被还原生成NO气体,其余的$\frac{3}{4}$均在溶液中.
解答 解:由于反应后有金属剩余,即反应后所得溶液中不可能含有Fe3+,生成物中金属离子均为+2价.设金属为M,生成的硝酸盐为M(NO3)2,发生反应:3M+8HNO3(稀)═3M(NO3)2+2NO↑+4H2O,NO3-在反应中有$\frac{1}{4}$被还原生成NO气体,其余的$\frac{3}{4}$均在溶液中,即反应后溶液中c(NO3-)=1mol/L×$\frac{3}{4}$=0.75 mol/L,
故选:C.
点评 本题考查混合物的计算、氧化还原反应的有关计算,根据金属有剩余判断反应后金属表现为+2价是解题关键,难度中等.

练习册系列答案
相关题目
3.能用溶解、过滤、蒸发、结晶分离的一组混合物是( )
| A. | 酒精和水 | B. | 氯化钠和碳酸钠 | ||
| C. | 碳酸钙和二氧化锰 | D. | 碳酸钙和氯化钠 |
4.在一定条件下,下列微粒的还原性顺序为Cl-<Br-<Fe2+<I-<SO2,由此判断以下各反应在溶液中不能发生的是( )
| A. | 2Br-+4H++SO${\;}_{4}^{2-}$═SO2+Br2+2H2O | |
| B. | 2Fe3++SO2+2H2O═2Fe2++SO${\;}_{4}^{2-}$+4H+ | |
| C. | 2Fe2++Cl2═2Fe3++2Cl- | |
| D. | I2+SO2+2H2O═4H++SO${\;}_{4}^{2-}$+2I- |
4.实验用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体经历下列过程,Fe3+在PH=5时已完全沉淀,其分析错误的是:( )
样品$→_{①△}^{足量硫酸}$溶液Ⅰ$→_{②}^{H_{2}O_{2}}$溶液Ⅱ$→_{调PH=5}^{③CuO}$浊液$→_{过滤}^{④}$滤液Ⅲ$→_{冷却结晶}^{蒸发浓缩}$ $→_{洗涤}^{过滤}$CuSO4•5H2O晶体.
样品$→_{①△}^{足量硫酸}$溶液Ⅰ$→_{②}^{H_{2}O_{2}}$溶液Ⅱ$→_{调PH=5}^{③CuO}$浊液$→_{过滤}^{④}$滤液Ⅲ$→_{冷却结晶}^{蒸发浓缩}$ $→_{洗涤}^{过滤}$CuSO4•5H2O晶体.
| A. | 用18mol/L浓硫酸配制溶解所用4mol/L的稀硫酸,玻璃仪器一般只有3种 | |
| B. | 利用Cu(OH)2替代CuO也可调试溶液pH不影响实验结果 | |
| C. | 洗涤晶体:向滤出晶体的漏斗中加少量水浸没晶体,自然流下,重复2-3次 | |
| D. | 若要用实验测定所得硫酸铜晶体中结晶水的数目要用到坩埚和坩埚钳 |
11.下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:Ar(填具体元素符号或化学式,下同),非金属性最强的元素是:F.
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是:HClO4,碱性最强的化合物的化学式是:KOH.
(3)最高价氧化物是两性氧化物的元素是:Al;写出它的最高价氧化物与氢氧化钠反应的离子方程式:Al2O3+2OH-=2AlO2-+H2O.
(4)④与⑧形成的化合物的电子式是: ,该化合物所含化学键类型是:离子键(填“共价键”或“离子键”).
,该化合物所含化学键类型是:离子键(填“共价键”或“离子键”).
(5)试设计实验方案比较④与⑤的化学性质(金属性),有关实验步骤、现象和结论填入下表
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ||
| 4 | ⑩ |
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是:HClO4,碱性最强的化合物的化学式是:KOH.
(3)最高价氧化物是两性氧化物的元素是:Al;写出它的最高价氧化物与氢氧化钠反应的离子方程式:Al2O3+2OH-=2AlO2-+H2O.
(4)④与⑧形成的化合物的电子式是:
 ,该化合物所含化学键类型是:离子键(填“共价键”或“离子键”).
,该化合物所含化学键类型是:离子键(填“共价键”或“离子键”).(5)试设计实验方案比较④与⑤的化学性质(金属性),有关实验步骤、现象和结论填入下表
| 实验步骤 | 实验现象与结论 |
| . |
 、
、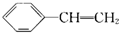 、
、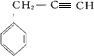 .
.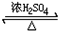 CH3COOC2H5+H2O;④2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;⑤CH3CH2Br+NaOH$→_{△}^{醇}$CH2=CH2↑+NaBr+H2O.
CH3COOC2H5+H2O;④2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;⑤CH3CH2Br+NaOH$→_{△}^{醇}$CH2=CH2↑+NaBr+H2O.